Efficacy
PREVYMIS® Efficacy
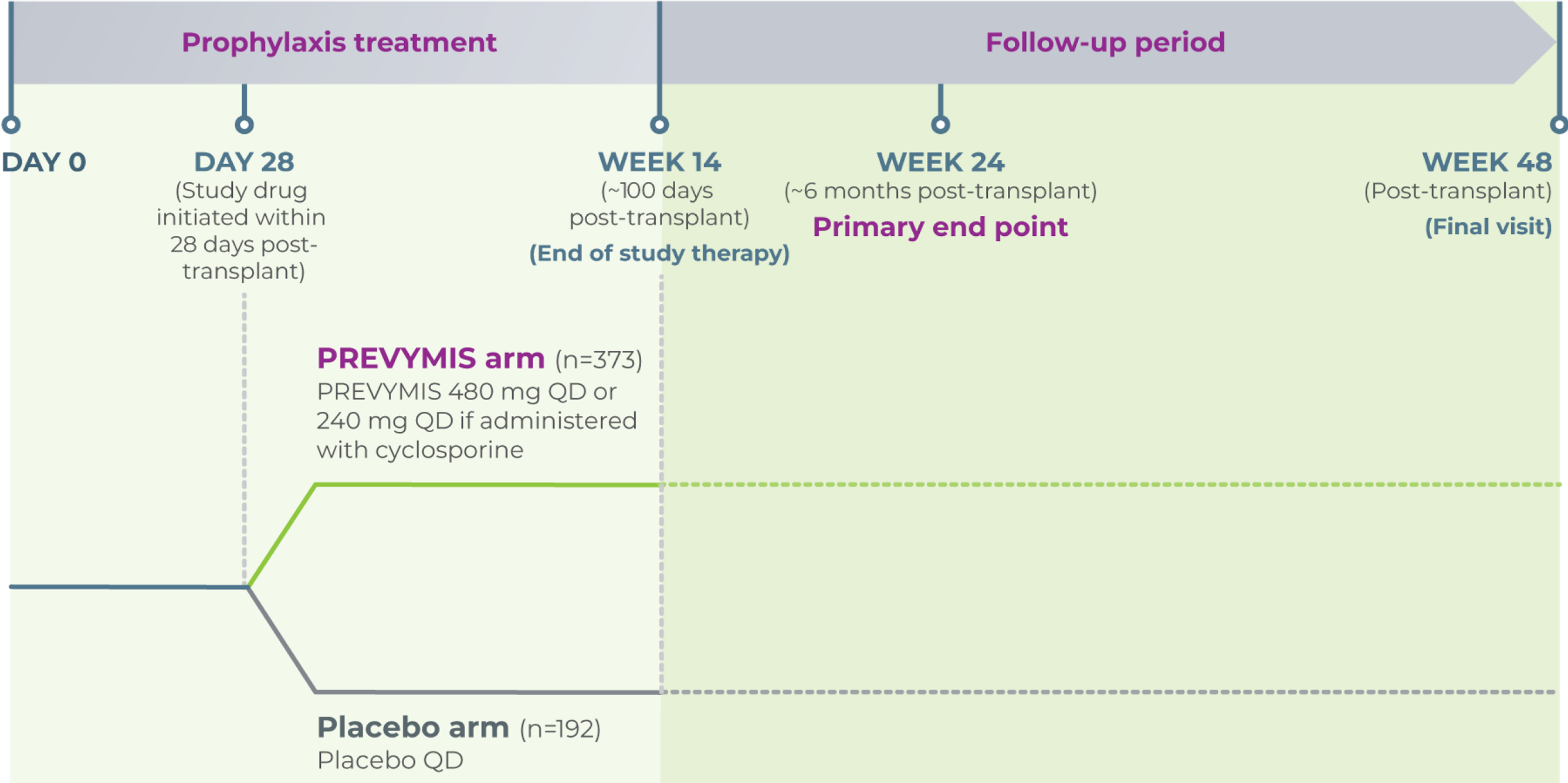
Study design
CMV prophylaxis was assessed in a randomized, multicenter, double-blind, placebo-controlled, pivotal, phase 3 study of adult CMV seropositive recipients (R+) of allogeneic HSCT. Patients were randomized (2:1) to PREVYMIS® or placebo and stratified by investigational site and risk (high vs low) for CMV reactivation at the time of study entry (n=565).
The protocol suggested thresholds for the initiation of PET during the treatment period were >150 copies/mL for high-risk recipients and >300 copies/mL for low-risk post-transplant, and a threshold of >300 copies/mL for all recipients thereafter period
Adapted from Ljungman P, Schmitt M, Marty FM, et al. A mortality analysis of letermovir prophylaxis for cytomegalovirus(CMV) in CMV-seropositive recipients of allogeneic hematopoietic cell transplantation. Clin Infect Dis. 2020; 70(8):1525- 1533. https://doi.org/10.1093/cid/ciz490 https://creativecommons.org licenses/by/4.0
Standard-of-care CMV preemptive therapy (PET) was initiated if CMV viremia was considered clinically significant
Median time to starting study drug was 9 days after transplantation
Superior efficacy in CMV prophylaxis
The primary end point was the proportion of patients, among patients without detectable CMV DNA at randomization, who had clinically significant CMV infection through week 24 after transplantation. Key prespecified secondary end points were the proportion of patients with clinically significant CMV infection through week 14 and the time to clinically significant CMV infection in the primary efficacy population.
PREVYMIS® Demonstrated Superior Efficacy Over Placebo in the Primary Endpoint: Clinically Significant CMV Infection at Week 24 (Non-completer=Failure Approach)
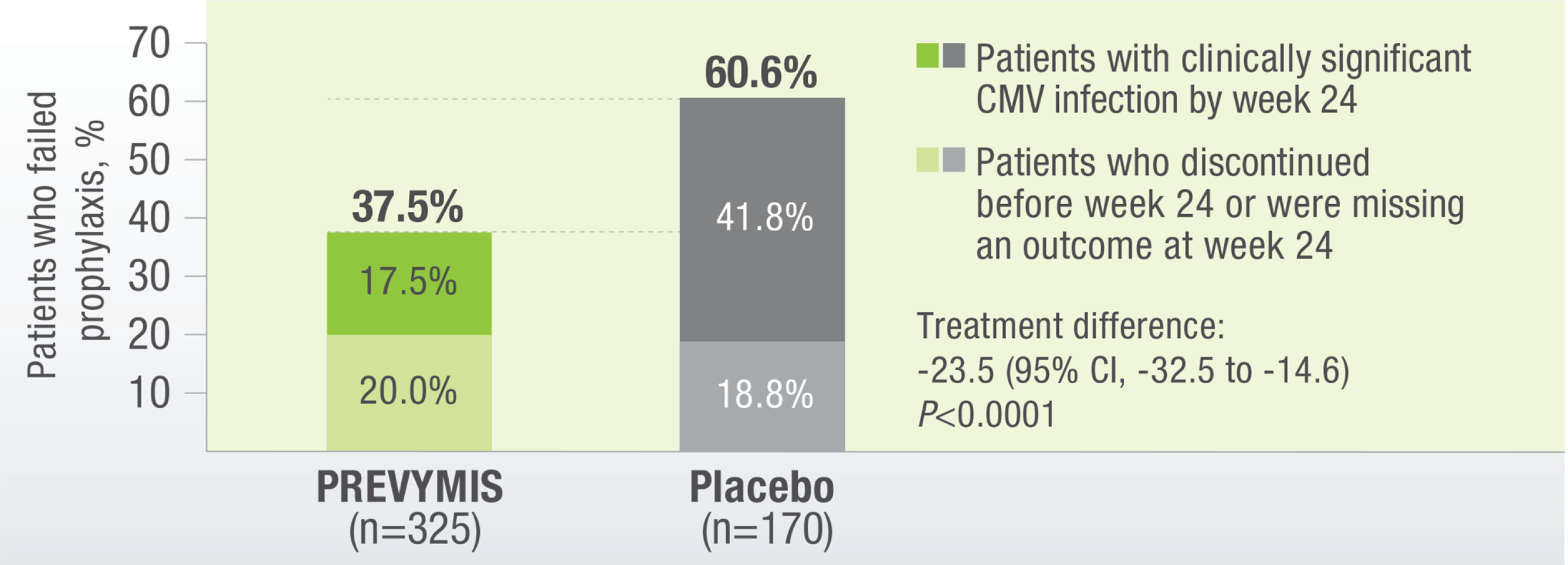
PREVYMIS® demonstrated a significantly lower rate of onset of csCMV infection vs placebo
The secondary endpoint was determined by using the Kaplan-Meier event rate of clinically significant CMV infection among letermovir recipients was 18.9% (95% CI, 14.4 to 23.5), as compared with 44.3% (95% CI, 36.4 to 52.1%) among placebo recipients, by week 24 after transplantation (P<0.001). The following graph shows how effective PREVYMIS® is (vs Placebo) of preventing CMV.1
Time to onset of clinically significant CMV infection through Week 24 post-transplanta
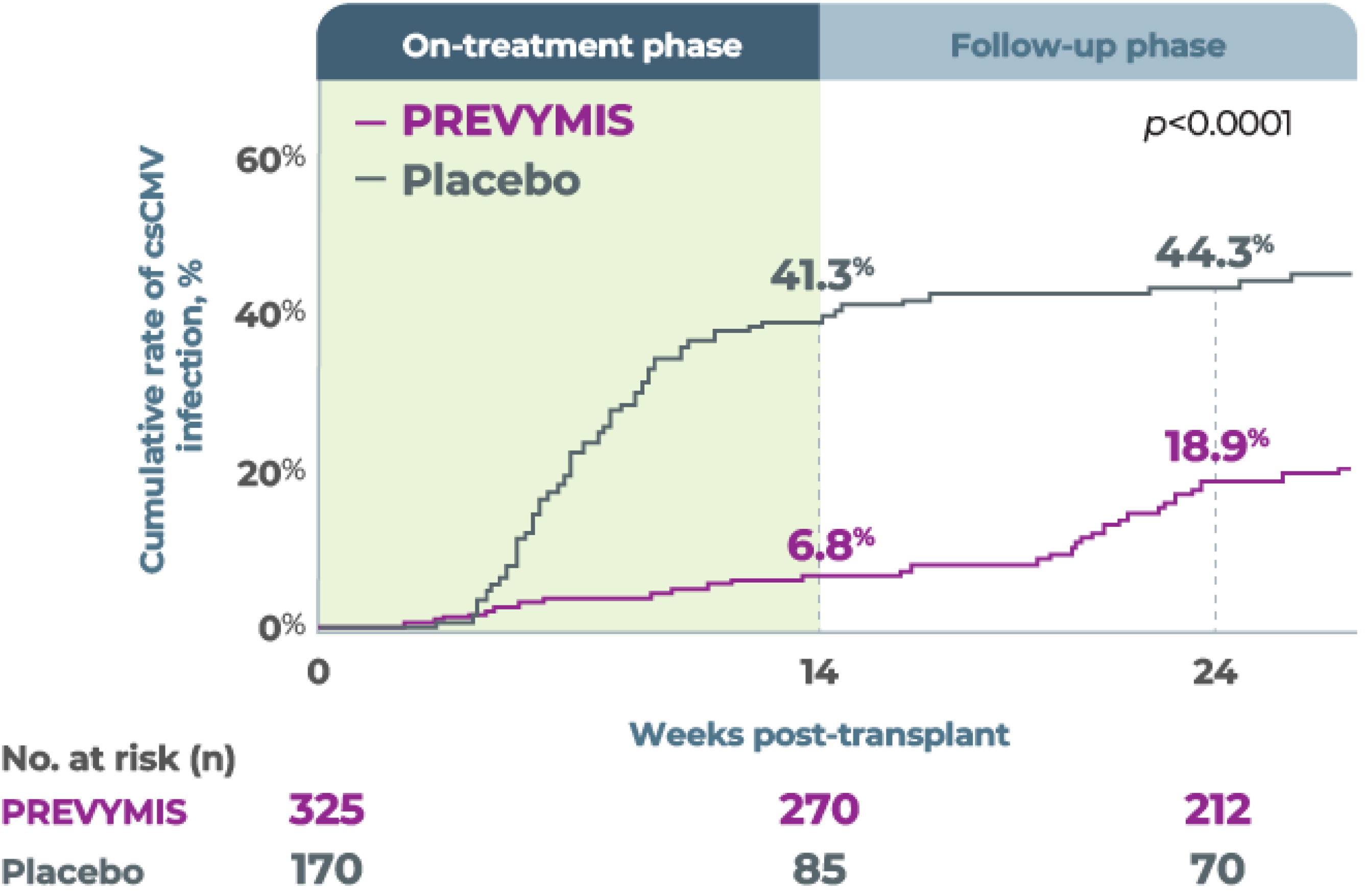
aClinically significant CMV infection was defined as the occurrence of either CMV end-organ disease or initiation of anti-CMV PET based on documented CMV viremia and the clinical condition of the patient.
The following graph outlines the baseline distribution of CMV-positive (CMV R+) transplant recipients, highlighting those with additional risk factors for CMV reactivation.
Recipients at high risk for CMV reactivation2
Recipients were considered high risk if they met 1 or more of the following criteria:

- Human leukocyte antigen (HLA)- related (sibling) donor with at least 1 mismatch at 1 of the following 3 HLA-gene loci: HLA-A, -B, or -DR
- Haploidentical donor
- Unrelated donor with at least 1 mismatch at 1 of the following 4 HLA-gene loci: HLA-A, -B, -C, or -DRB1
- Use of umbilical cord blood as the stem cell source
- Use of ex vivo T-cell–depleted grafts
- Grade 2 or greater GVHD, requiring systemic corticosteroids
References:
- Marty FM et al., Letermovir Prophylaxis for Cytomegalovirus in Hematopoietic-Cell Transplantation. N Engl J Med. 2017 Dec 21;377(25):2433-2444. doi: 10.1056/NEJMoa1706640. Epub 2017 Dec 6. PMID: 29211658.
- Green ML et al.,Cytomegalovirus viral load and mortality after haemopoietic stem cell transplantation in the era of pre-emptive therapy: a retrospective cohort study. Lancet Haematol. 2016 Mar;3(3):e119-27.
Prevymis (letermovir) 240 mg og 480mg, tabletter og konsentrat til infusjonsvæske, oppløsning.
Indikasjoner: Profylakse mot cytomegalovirus (CMV)-reaktivering og -sykdom hos voksne og pediatriske pasienter som veier minst 15 kg (dersom gitt som tablett) eller minst 5 kg (dersom gitt som infusjonsvæske), som er CMV-seropositive mottagere [R+] i forbindelse med allogen hematopoetisk stamcelletransplantasjon (HSCT). Profylakse mot CMV-sykdom hos CMV-seronegative voksne og pediatriske pasienter som veier minst 40 kg (uavhengig av formulering), som har mottatt et nyretransplantat fra en CMV-seropositiv donor [D+/R-]. Det bør tas hensyn til offisielle retningslinjer for riktig bruk av antivirale midler.
Dosering: Bør initieres av en lege med erfaring i behandling av pasienter som har hatt en allogen hematopoetisk stamcelletransplantasjon eller nyretransplantasjon. Tabletter og konsentrat til infusjonsvæske, oppløsning kan brukes om hverandre etter legens vurdering. Anbefalt dose er 480 mg daglig. Ved samtidig bruk av ciklosporin, skal dosen reduseres til 240 mg en gang daglig. Sikkerhet og effekt hos pasienter under 18 år har ikke blitt fastslått. For oppstart og dosejustering se pkt. 4.2 i SPC. HSCT: Bør startes på transplantasjonsdagen og ikke senere enn 28 dager etter HSCT. Profylakse bør fortsettes i 100 dager etter HSCT. Forlenget behandling utover 100 dager kan være fordelaktig hos noen pasienter med høy risiko. Sikkerhet og effekt ved bruk i mer enn 200 dager ikke undersøkt. Nyretransplantasjon: Bør startes på transplantasjonsdagen og ikke senere enn 7 dager etter nyretransplantasjonen, og fortsettes i 200 dager etter transplantasjonen.
Pakninger og priser (AUP): Tabletter 28 stk.: kr 55506.70. Konsentrat til infusjonsvæske (hettegl. 12ml) 1 stk.: kr 2252.40. Reseptgruppe C. Tabletter: H-resept. HSCT besluttet innført av Beslutningsforum 25.02.2019.
Utvalgt sikkerhetsinformasjon:
Kontraindikasjoner: Samtidig administrering med pimozid, ergotalkaloider eller johannesurt (prikkperikum). Når letermovir kombineres med ciklosporin er samtidig bruk av dabigatran, atorvastatin, simvastatin, rosuvastatin eller pitavastatin kontraindisert.
Forsiktighetsregler:
- Anbefales ikke ved alvorlig (Child-Pugh klasse C) nedsatt leverfunksjon, eller ved moderat nedsatt leverfunksjon kombinert med moderat eller alvorlig nedsatt nyrefunksjon. Effekt og sikkerhet ikke vist ved terminal nyresykdom.
- Overvåkning av CMV-DNA: Sikkerhet og effekt er fastslått ved negativ CMV-DNA-test i forkant av oppstart av profylakse. I tilfeller med klinisk signifikant CMV-DNAemi eller sykdom, bør profylakse med letermovir stoppes, og standard forebyggende behandling mot CMV («pre-emptive therapy» (PET)) eller behandling bør startes opp. Hos pasienter der letermovirprofylakse startes opp og CMV-DNA-test ved baseline senere blir funnet å være positiv, kan profylakse fortsettes dersom PET-kriteriene ikke er oppfylt.
- Risiko for bivirkninger eller redusert terapeutisk effekt som følge av legemiddelinteraksjoner.
Interaksjoner: Se tabell 1 pkt. 4.5 i SPC for interaksjoner og doseringsanbefalinger for andre legemidler. Interaksjonspotensial og kliniske konsekvenser kan være forskjellige avhengig av hvilket letermovir-regime som brukes og om ciklosporin gis samtidig. Når administreringsvei endres, eller dersom immunsuppressivt middel endres, bør man igjen sjekke anbefalinger som gjelder samtidig administrering med andre legemidler (se tabell pkt. 4.5 i SPC). Økt overvåking av ciklosporin, takrolimus, sirolimus anbefales de første to ukene etter å ha startet eller avsluttet letermovir i tillegg til ved endring av administreringsvei for letermovir.
Graviditet, amming, fertilitet: Anbefales ikke under graviditet og hos fertile kvinner som ikke bruker prevensjon. Overgang i morsmelk er ukjent. Det må tas en beslutning om amming skal opphøre eller behandling avstås fra, basert på nytte-/risikovurdering for barnet og for moren.
Bivirkninger: De mest vanlige bivirkningene er kvalme (7,2 %), diaré (2,4 %) og oppkast (1,9 %).
Konsulter PREVYMIS SPC 04/2025 før forskrivning eller bruk for komplett informasjon om dosering, kontraindikasjoner, advarsler og forsiktighetsregler, interaksjoner og bivirkninger.
MSD (Norge) AS, PO Box 1S79 Vika, 0118 Oslo, tlf. 32 20 73 00 faks 32 20 73 10. Copyright © 2025 Merck & Co., lnc., Rahway, NJ, USA and its affiliates. All rights reserved.

