Nye perspektiv for pasienten i fremtidens kreftbehandling

Hva er verdien av tidlige endepunkt i kliniske kreftstudier?

Lesetid, 5 minutter 237
En klinisk studie i senere fase har som mål å evaluere den kliniske effekten og sikkerheten av en ny behandling. Valg av endepunkt* i en klinisk studie er derfor avgjørende for at man på en objektiv måte skal kunne måle den kliniske verdien av en ny behandling sammenliknet med standardbehandling.
Innen kreftstudier har man tradisjonelt hatt som mål å undersøke om en ny behandling øker levetiden til pasienten. En har derfor målt effekten av behandling ved å se hvor lenge pasienten lever med den nye behandlingen sammenliknet med kontrollarm eller dagens standardbehandling. Effektmålet som kalles totaloverlevelse (OS), har vært en gullstandard innen kreftforskning da det er enkelt å måle og lite sårbart for fortolkninger.
Kreftbehandling er imidlertid i ferd med å bevege seg inn i en ny fase der man undersøker effekten av behandling i tidligere stadier av kreftsykdommen. Rasjonalet for å gi behandling i tidligere stadier av sykdommen er å kunne bedre prognose med redusert risiko for tilbakefall, og til syvende og sist, at behandlingen skal kurere pasienten. For kliniske studier som inkluderer pasienter med kreft har OS flere ulemper som effektmål:
- Det kreves svært lang oppfølgingstid før man kan få svar på om behandlingen medførte lenger overlevelse (median overlevelse (halvparten av pasienten er døde) bør være nådd for å kunne trekke en konklusjon, spesielt i palliative studier).
- Overlevelse påvirkes av flere ukontrollerte faktorer underveis i pasientens sykdomforløp som for eksempel senere behandlingslinjer og dødsfall som ikke skyldes kreftsykdommen.
Det kan derfor være mer hensiktsmessig å måle nytten av behandlingen med andre effektmål enn OS ved tidligere stadier av kreftsykdommen.
Ordet «surrogat» betyr «i stedet for» eller «erstatning for noe bedre». Surrogatendepunkter omgår de overnevnte begrensningene som ligger i måling av OS fordi de kan måles tidligere i forløpet og dermed gi mindre frafall og flere pasienter vil dermed inngå i effektanalysene1. Bruk av surrogatendepunkt krever også en mindre studiepopulasjon sammenliknet med studier med OS som endepunkt2.
Surrogatendepunkter i avansert og tidlig kreftsykdom
Verdien av surrogatendepunkter i kliniske kreftstudier er avhengig av hvilke sykdomsstadier studien er designet for.
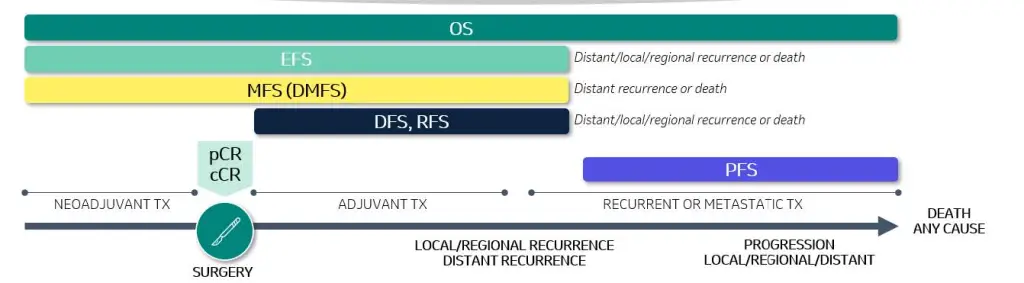
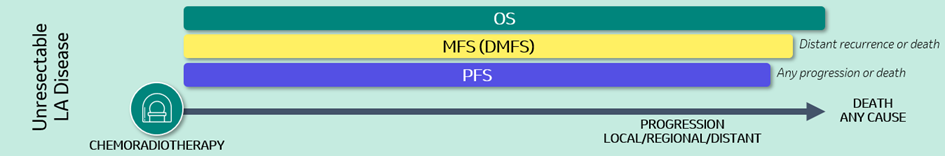
For ikke-resektabel og metastatisk sykdom der målet med behandling ikke er å kurere pasienten men å forlenge levetiden, er progresjonsfri overlevelse (PFS) et verdifullt endepunkt, sammen med OS (fig1). PFS måler tiden fra en pasient blir randomisert inn i en studie og fram til den første av følgende to hendelser inntreffer: objektivt målbar sykdomsprogresjon eller dødsfall. Dette surrogatendepunktet er robust og kan måles etter en relativt kort oppfølgingsperiode, og blir ikke påvirket av annen påfølgende behandling. PFS er derfor, for noen kreftformer i senere stadier, vurdert som akseptabelt endepunkt ved forenklet godkjenning av nye legemidler.3
*A surrogate endpoint is a clinical trial endpoint used as a substitute for a direct measure of how a patient feels, functions, or survives
PFS har i midlertidig noen viktige begrensninger: endepunktet tar ikke hensyn til senere behandling, hvilket gjør det vanskelig å anslå overlevelsesgevinsten av den nye behandlingen. (3) Figur 1 viser en oversikt over surrogatendepunkter og tidsperspektiver for disse endepunktene i behandlingsforløp.
Figur 1 Tidslinje for alternative endepunkter i behandlingsforløp*
* bilde laget av MSD
Det andre behandlingsmål for pasienter med kreft i tidlig stadium er annerledes enn ved sene stadier. Her er målet å kurere pasienten, og dermed må klinisk effekt også vurderes ut ifra andre kriterier.
Sykdomsfri overlevelse (DFS) eller residivfri overlevelse (RFS) og hendelsesfri overlevelse (EFS) brukes i hovedsak for å måle effekten av en førbehandling (neoadjuvant) eller tilleggsbehandling til kurativ kirurgi eller strålebehandling (adjuvant) (fig. 1). DFS og RFS måles fra en pasient blir randomisert inn i en studie og frem til pasienten får et tilbakefall av sykdommen eller dør, uavhengig av dødsårsak.
EFS måles fra en pasient blir randomisert inn i en studie og frem til et av følgende opptrer: pasienten får sykdomsprogresjon som forhindrer kirurgisk behandling/pasienten får tilbakefall av sykdommen enten lokalt eller med fjernmetastaser, pasienten dør uavhengig av dødsårsak2.
Valg av DFS og EFS som endepunkt avhenger av tidspunktet for randomisering. Når EFS brukes som effektmål blir pasientene randomisert til de ulike behandlingsalternativene før de gjennomgår radikal kirurgi eller strålebehandling og er derfor egnet for å måle effekt av en neoadjuvant behandling. (2) Til sammenlikning brukes DFS der randomisering skjer etter radikal behandling og måler effekten av å gi en adjuvant behandling etter radikal kirurgi eller stråleterapi. DFS og EFS har særlig styrke i studier der en stor prosentandel av pasientene oppnår komplett respons (CR) fra kjemoterapi, og i studier med lang forventet overlevelse som gjør OS vanskelig å måle2.
*A surrogate endpoint is a clinical trial endpoint used as a substitute for a direct measure of how a patient feels, functions, or survives
Hvor gode er tidlige endepunkt til å predikere totaloverlevelse?
Statistiske modeller som anslår sammenhengen mellom PFS og OS har vist at dersom median overlevelse etter sykdomsprogresjon er kort (<12 måneder), så er PFS et fornuftig alternativ til OS2. Blant annet har studier fra avansert tarmkreft og lungekreft vist at korrelasjonen mellom PFS og OS er sterk. (4-7) I motsetning har studier fra brystkreft eller tilbakevendende eggstokkreft, der overlevelsen etter sykdommen progredierer er lang, vist et mer sprikende forhold mellom PSF og OS. Trolig skyldes dette at det er god tilgang på effektiv behandling selv etter at sykdommen har progrediert4,8.
Verdien av EFS som surrogat endepunkt er evaluert i flere studier og metaanalyser 9-13. En metaanalyse av 7 kliniske studier for neoadjuvant behandling av brystkreft demonstrerte en moderat korrelasjon mellom EFS og OS10. Derimot viser en annen nyere metaanalyse som inkluderte 45 kliniske studier, at 3-års EFS var en signifikant predikator for 5-års OS13. Resultatene fra en metaanalyse av 8 neoadjuvante studier innen gastric adenocarcinom11 og 2 metaanalyser for lokalavansert hode og hals kreft9, 12 visste sterk korrelasjon mellom EFS og OS.
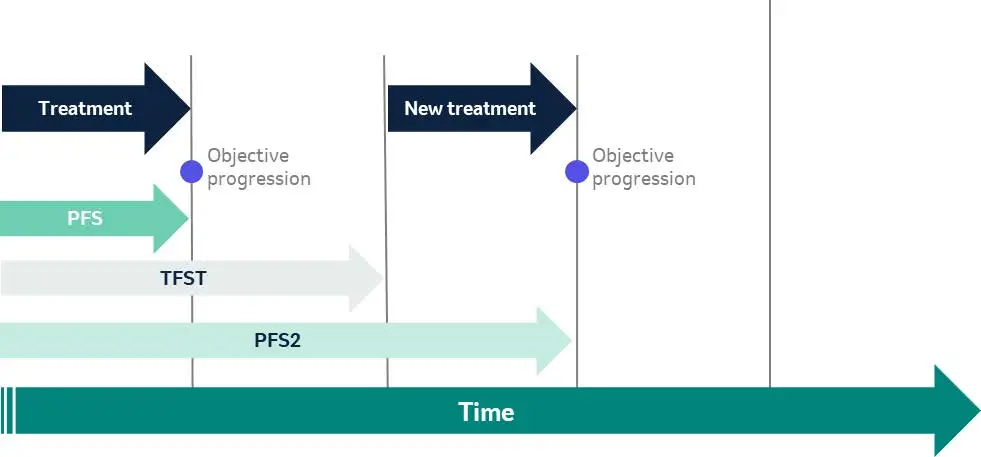
Det finnes i tillegg en rekke andre surrogatendepunkter som måler tilleggsverdier av behandlingen utover overlevelse, samt estimerer en eventuell klinisk progresjon av kreftsykdommen. Dette inkluderer endepunkter som måler overlevelse uten fjernmetastaser (DMFS), tid til neste behandlingslinje (TFST) og tid til sykdomsprogresjon i neste behandlingslinje (PFS2).
Figur 2 Alternative endepunkter i kreftstudier
* Bilde laget av MSD
PFS2 er stadig mer brukt fordi det overkommer noen av begrensingene med å måle PFS. PFS2 måler hvorvidt den nye behandlingen fortsetter å gi en klinisk fordel, selv etter pasienten opplever sykdomsprogresjon. Et positivt utfall av PFS2 gir dermed økt trygghet i at den nye behandlingen ikke har en negativ innvirkning på pasientens respons til senere behandlingslinjer14.
Flere kliniske surrogatendepunkt er velegnet til å måle klinisk effekt og er godtatt som primære endepunkt i bekreftende fase III studier.
Totaloverlevelse er fortsatt å regne som gullstandarden innen kliniske kreftstudier, men med den stadige nyutviklingen innen feltet, der behandling gis på tidligere stadier av sykdommen, har surrogatendepunktene en økende betydning når nye kliniske studier skal designes. Faktorer som type kreft, stadium, behandlingsmål og forventet overlevelse er alle nyanser som må med i vurderingen når surrogatendepunkter skal brukes for å vurdere den kliniske betydningen av en ny behandling.
*A surrogate endpoint is a clinical trial endpoint used as a substitute for a direct measure of how a patient feels, functions, or survives
*Når skjult identitet brukes i undersøkelser, vil ingen identifiserbar informasjon, som f.eks. nettlesertype og -versjon, operativsystem eller e-postadresse, bli lagret med svaret. Dette er for å beskytte respondentens identitet.
Har du spørsmål rundt tidlige endepunkt?
Ta kontakt med meg, Andrey Sokolov

Referanser:
- Looking to the future: oncology endpoints. Summary report of a joint workshop held on of 3 July2017 by the Academy of Medical Sciences and the Association of the British Pharmaceutical Industry https://acmedsci.ac.uk/file-download/41135280
- FDA. Clinical Trial Endpoints for the Approval of Cancer Drugs and Biologics Guidance forIndustry [Available from:https://www.fda.gov/media/71195/download.
- Kilickap S, Demirci U, Karadurmus N, Dogan M, Akinci B, Sendur MAN. Endpoints in oncologyclinical trials. J buon. 2018;23(7):1-6.
- Sherrill B, Kaye JA, Sandin R, Cappelleri JC, Chen C. Review of meta-analyses evaluatingsurrogate endpoints for overall survival in oncology. Onco Targets Ther. 2012;5:287-96.
- Foster NR, Qi Y, Shi Q, Krook JE, Kugler JW, Jett JR, et al. Tumor response and progression-freesurvival as potential surrogate endpoints for overall survival in extensive stage small-cell lung cancer:findings on the basis of North Central Cancer Treatment Group trials. Cancer. 2011;117(6):1262-71.
- Tang PA, Bentzen SM, Chen EX, Siu LL. Surrogate end points for median overall survival inmetastatic colorectal cancer: literature-based analysis from 39 randomized controlled trials of first-linechemotherapy. J Clin Oncol. 2007;25(29):4562-8.
- Buyse M, Burzykowski T, Carroll K, Michiels S, Sargent DJ, Miller LL, et al. Progression-freesurvival is a surrogate for survival in advanced colorectal cancer. J Clin Oncol. 2007;25(33):5218-24.
- Broglio KR, Berry DA. Detecting an overall survival benefit that is derived from progression-freesurvival. J Natl Cancer Inst. 2009;101(23):1642-9.
- Black CM, Keeping S, Mojebi A, Ramakrishnan K, Chirovsky D, Upadhyay N, et al. CorrelationBetween Early Time-to-Event Outcomes and Overall Survival in Patients With Locally Advanced Headand Neck Squamous Cell Carcinoma Receiving Definitive Chemoradiation Therapy: Systematic Reviewand Meta-Analysis. Front Oncol. 2022;12:868490.
- Gyawali B, D’Andrea E, Franklin JM, Kesselheim AS. A correlation analysis to assess event-freesurvival as a trial-level surrogate for overall survival in early breast cancer. EClinicalMedicine.2021;32:100730.
- Liu H, Wang Y, Qi C, Xie T, Peng Z, Li J, et al. Evaluation of Event-Free Survival Surrogating OverallSurvival as the Endpoint in Neoadjuvant Clinical Trials of Gastroesophageal Adenocarcinoma. Frontiersin Oncology. 2022;12.
- Michiels S, Le Maître A, Buyse M, Burzykowski T, Maillard E, Bogaerts J, et al. Surrogateendpoints for overall survival in locally advanced head and neck cancer: meta-analyses of individualpatient data. Lancet Oncol. 2009;10(4):341-50.
- Fasching PAH, M.; Haiderali, A.; Xue, W.; Pan, W.; Karantza, V.; Yang, F.; Truscott, J.; Xin, Y.;O’Shaughnessy, J. 186P Evaluation of event-free survival as a surrogate for overall survival in early-stagetriple-negative breast cancer following neoadjuvant therapy. Annals of Oncology. 2022;33:S621.
- Wilson MK, Karakasis K, Oza AM. Outcomes and endpoints in trials of cancer treatment: thepast, present, and future. Lancet Oncol. 2015;16(1):e32-42.
*A surrogate endpoint is a clinical trial endpoint used as a substitute for a direct measure of how a patient feels, functions, or survives

