KEYNOTE- A18-studien
KEYNOTE-A18-studien

Siden 1999 har ekstern strålebehandling i kombinasjon med kjemoterapi etterfulgt av brakyterapi vært standard behandling for pasienter med lokalavansert livmorhalskreft. Selv om det har skjedd fremskritt på strålebehandlingsfeltet og behandlingen av pasientene har en kurativ intensjon, er det fortsatt potensiale for å forbrede prognosen for pasienter med lokalavansert livmorhalskreft i stadium III-IVA 1,2.
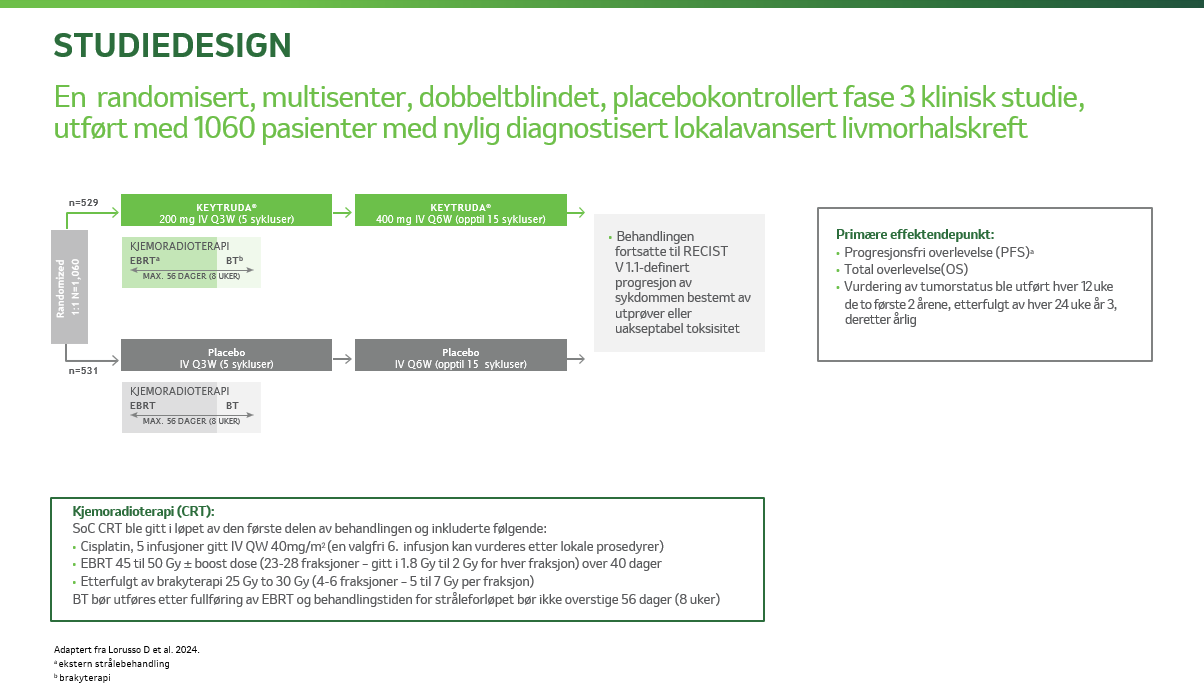
KEYNOTE-A18 (KN-A18) er en randomisert, dobbeltblindet, placebokontrollert multisenterstudie hvor det ble undersøkt effekten av pembrolizumab i tillegg til cisplatin og strålebehandling hos pasienter med lokalavansert livmorhalskreft, hvor progresjonsfri overlevelse som vurdert av utprøver ihht RECIST 1.1 eller histopatologisk bekreftet og totaloverlevelse var de primære endepunktene3. På denne siden kan du lese mer om KN-A18 og resultatene fra studien.
INDIKASJON, PRIS, REFUSJON OG UTLEVERINGSBETINGELSER:
I kombinasjon med kjemoradioterapi (ekstern strålebehandling etterfulgt av brakyterapi) til behandling av FIGO 2014 stadium III-IVA lokalavansert livmorhalskreft hos voksne som ikke har mottatt tidligere definitiv behandling.
Pris: 40 781,80 NOK (Apotek utsalgspris). Reseptgruppe: C, Refusjon: H-resept. Keytruda er inkludert i anbud for kreftlegemidler (LIS 2307) og selges med rabattert pris.
19. januar 2026
PASIENTPOPULASJONEN I STUDIEN BESTOD AV:
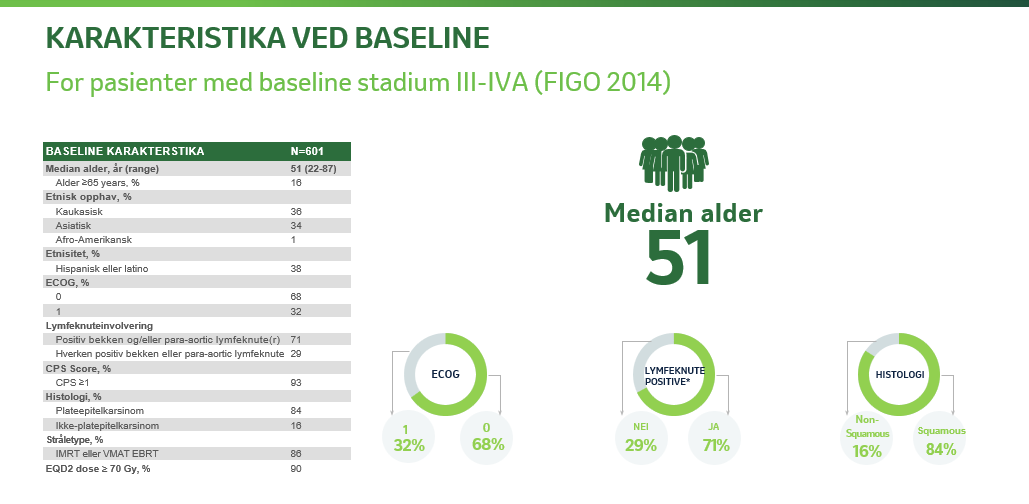
601 pasienter med FIGO (International Federation of Gynaecology and Obstetrics) 2014 stadium III – IVA (tumor involverer den ytre delen av vagina med eller uten utbredelse til bekkenveggen eller hydronefrose/ikke-fungerende nyre eller som har spredd seg til tilstøtende organer i bekkenet) med enten lymfeknutepositiv- eller lymfeknutenegativ sykdom.
459 pasienter med FIGO 2014 stadium IB2 – IIB (tumorlesjoner > 4 cm eller klinisk synlige lesjoner som har spredd seg utenfor uterus, men ikke til bekkenveggen eller den ytre tredjedelen av vagina) med lymfeknute-positiv sykdom.
Pasienter med autoimmun sykdom som krevde systemisk behandling innen 2 år med behandling eller en medisinsk tilstand som krevde immunsuppresjon kunne ikke inkluderes3.
STUDIEDESIGN OG KARAKTERISTIKA VED BASELINE
Pasientene ble randomisert 1:1 til behandling med enten KEYTRUDA® (pembrolizumab) i kombinasjon med cisplatin og strålebehandling, eller placebo i kombinasjon med cisplatin og strålebehandling3 .
Resultater primære effektendepunkt: PFS og OS
EFFEKTDATA FRA KEYNOTE-A183
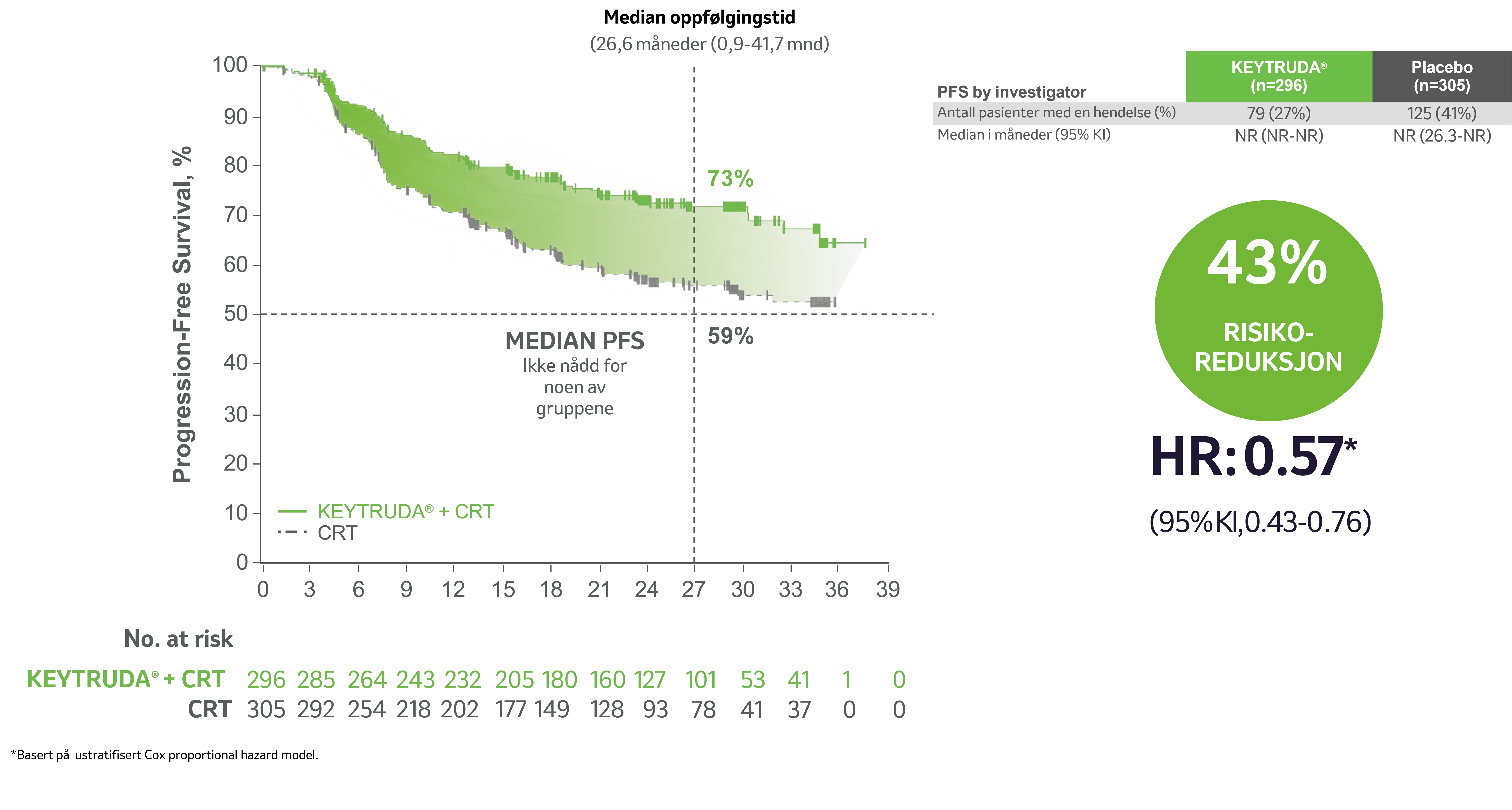
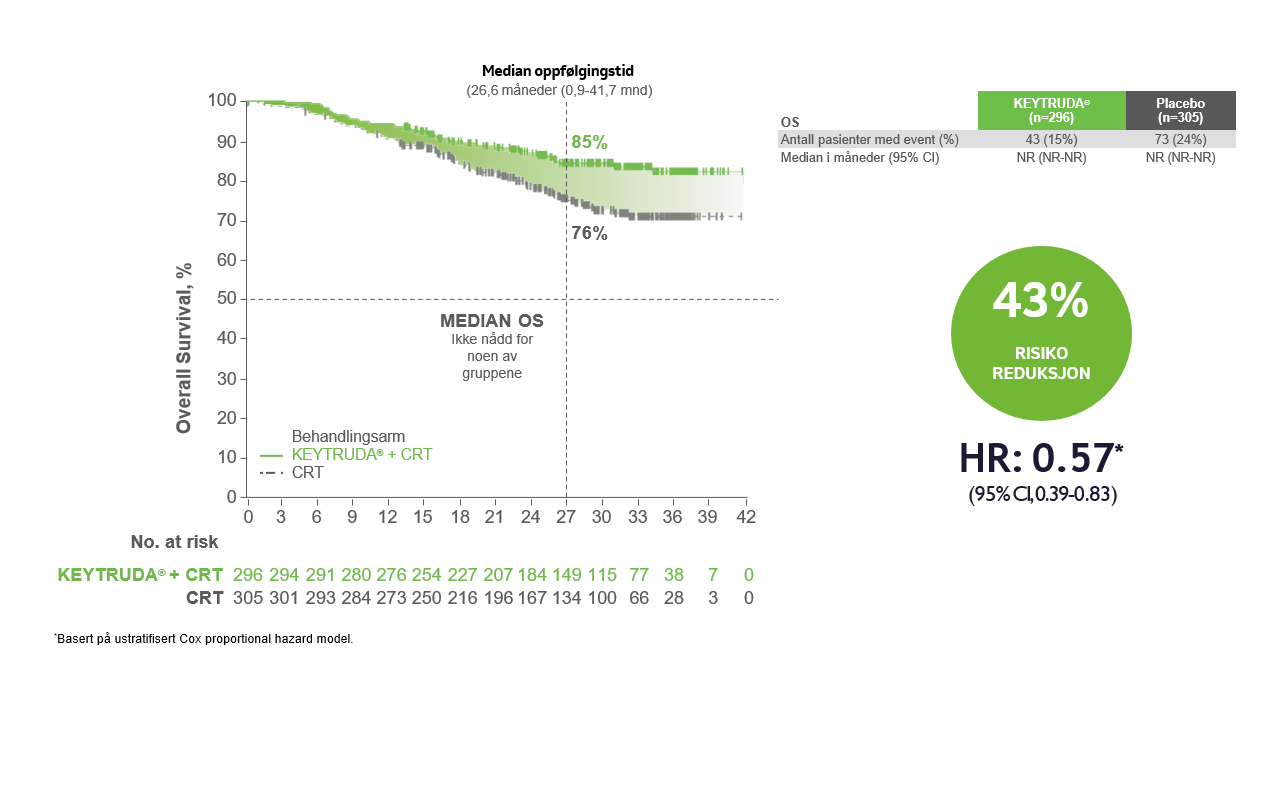
De primære effektendepunktene var progresjonsfri overlevelse (PFS) basert på utprøvers vurdering i henhold til RECIST v1.1 eller histopatologisk bekreftelse, og total overlevelse (OS). Studien viste statistisk signifikante forbedringer i progresjonsfri overlevelse fra den første pre-spesifiserte interimanalysen og total overlevelse fra den andre pre-spesifiserte interimanalysen i den totale populasjonen hos pasienter randomisert til pembrolizumab sammen med kjemoradioterapi (CRT) sammenlignet med placebo sammen med CRT:
• PFS ved IA1 (HR=0.70; 95% CI, 0.55–0.89; p =0.0020).
• OS ved IA2 (HR=0.67; 95% CI, 0.50–0.90; p =0.0040).
PROGRESJONSFRI OVERLEVELSE 3
Forbedring i PFS hos pasienter med FIGO 2014 stadium III til IVA
TOTAL OVERLEVELSE3
Forbedring i risiko for død hos pasienter med FIGO 2014 stadium III til IVA
Uønskede medisinske hendelser4
Sikkerhetsprofi len for KEYTRUDA® var i overensstemmelse med analyser fra tidligere studier. Det ble ikke identifisert noen nye bivirkninger i KEYNOTE A18-studien. Immunrelaterte bivirkninger kan oppstå ved behandling med KEYTRUDA®. For mer informasjon om dette, klikk her for å lese mer. Pasienter oppfordres til å alltid ha med seg et pasientkort med informasjon om behandling med KEYTRUDA®. Dette finnes på Felleskatalogen.no eller ved å kontakte MSD Norge
Behandlingsrelaterte medisinske hendelser av alle gradera for ITT-populasjonen, forekomst ≥ 20 % i en av armeneb
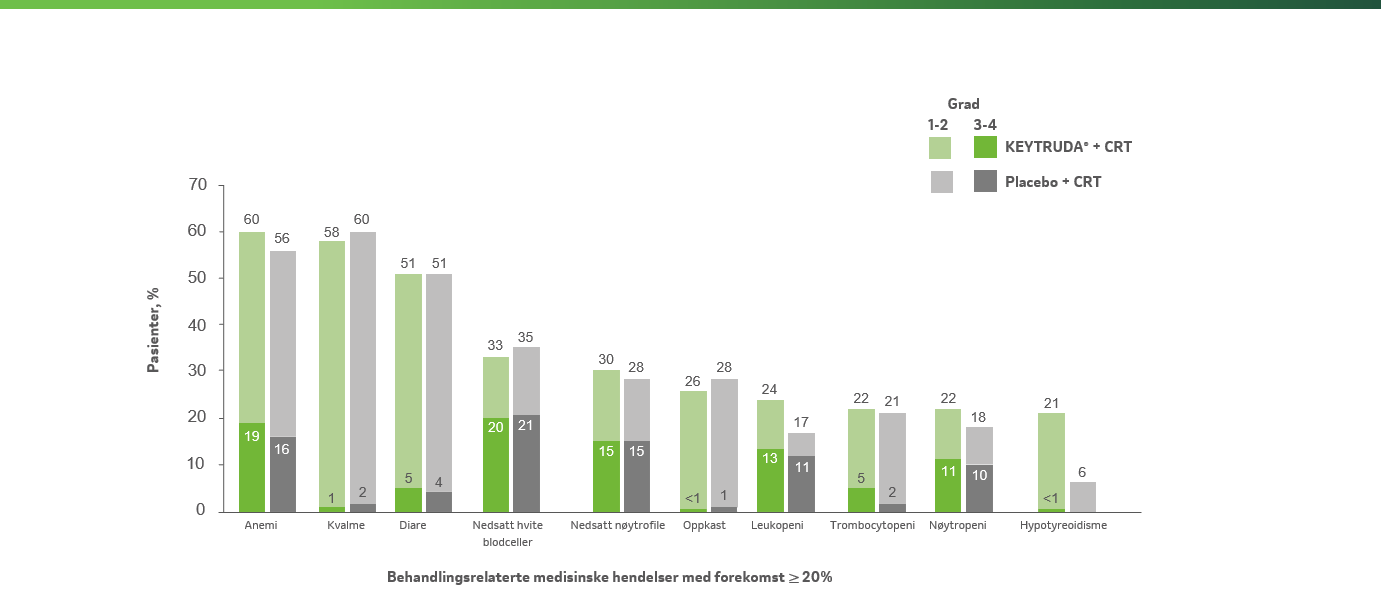
Adaptert fra Lorusso D et al. 2024.4
De ovennevnte dataene gjelder for hele studiepopulasjonen inkludert i studien, ikke bare for pasienter med stadium III-IVA
aGradert i henhold til NCI CTCAE v5.0. b Behandlingsrelaterte medisinske hendelser var hendelser som ble tilskrevet et av utprøvningslegemidlene av utprøverne. Behandlingsrelaterte medisinske hendelser som oppstod hos minst 20 % av pasientene i en av behandlingsarmene ble rapportert. Hendelsene er listet i synkende rekkefølge etter hyppighet i KEYTRUDA®–kjemoradioterapi-armen. Pasienter kan ha hatt mer enn én hendelse. Grad 5 behandlingsrelaterte medisinske hendelser var immunmediert gastritt (n=1) og perforasjon av tykktarmen (n=1) i KEYTRUDA®–kjemoradioterapi-armen, og benmargsvikt (n=1) og neutropen kolitt (n=1) i placebo–kjemoradioterapi-armen
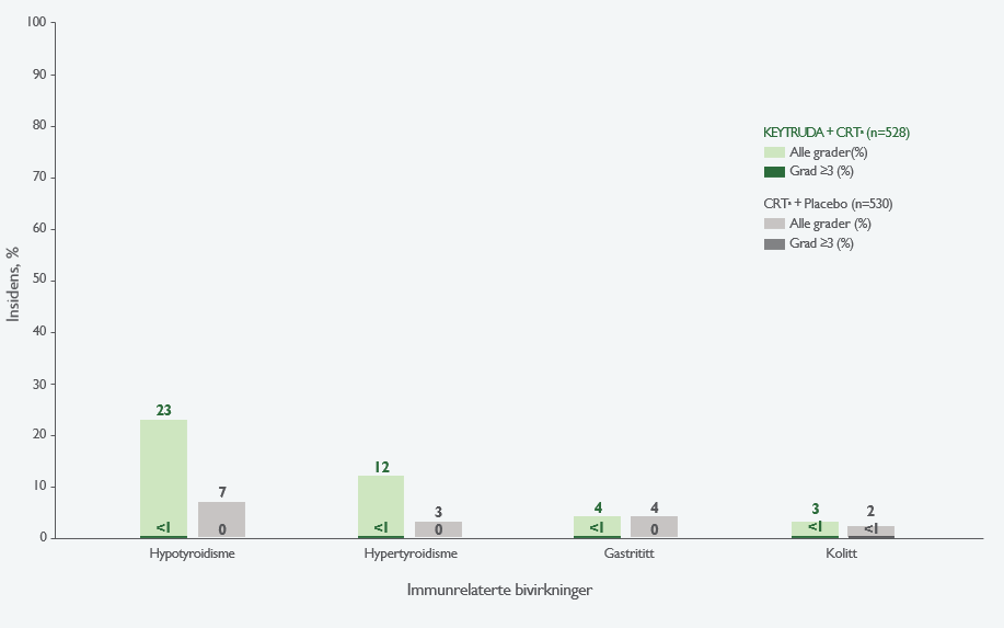
IMMUNRELATERTE MEDISINSKE HENDELSER4
Immunrelaterte medisinske hendelser av alle gradera for ITT-populasjonen, forekomst ≥ 20 % i en av armene
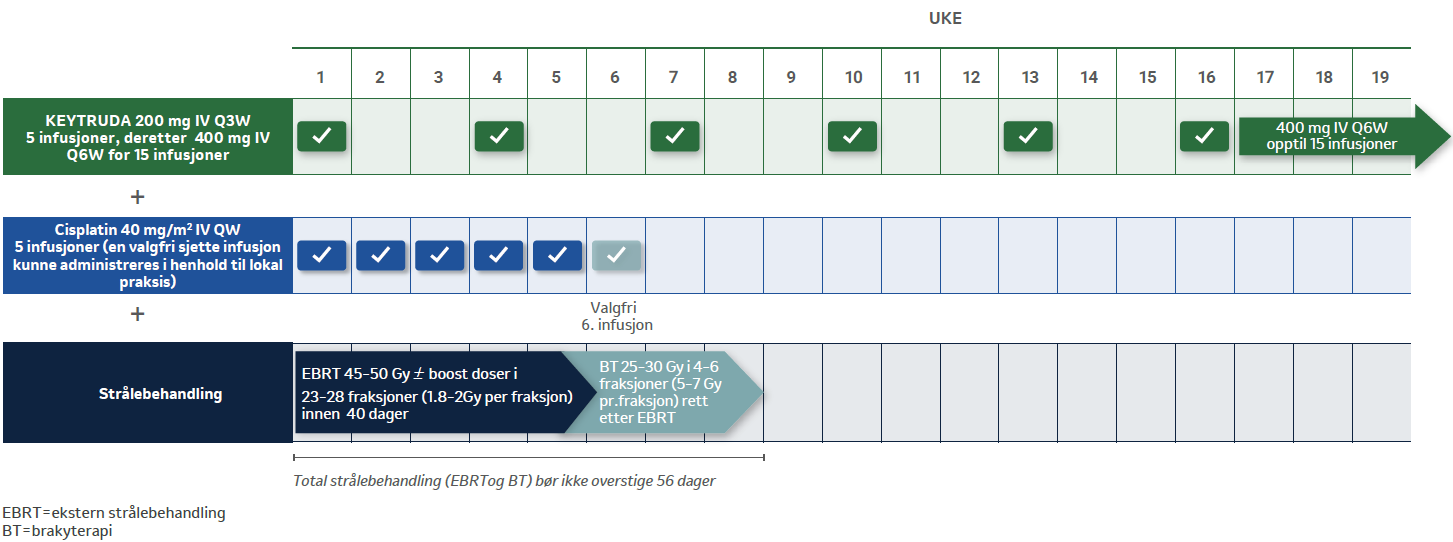
KN-A18: KEYTRUDA® + KJEMORADIOTERAPI DOSERING OG ADMINISTRERING3,4
De første 5 syklusene ble det gitt enten KEYTRUDA 200 mg eller placebo hver tredje uke i kombinasjon med kjemoradioterapi, med 5 sykluser ukentlig cisplatin (40 mg/m2) + ekstern strålebehandling, etterfulgt av brakyterapi.
Etter de 5 første syklusene, ble det gitt enten KEYTRUDA 400 mg hver 6. uke eller placebo i opp til 15 sykluser
Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
KEYTRUDA® kan gis hver 3. eller 6. uke. Les mer om dosering her: Keytruda – Dosering | MSD Innsikt.
Referanser
- Cancer in Norway rapport 2024, Folkehelseinstituttet cancer-in-norway-2024.pdf
- Lorusso D, et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet. 2024;403(10434):1341-1350
- Keytruda SPC November 2025, avsnitt 5.1
- Lorusso D, et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2024:S0140-6736(24)01808-7.