Praktisk behandlingsveiledning for metastatisk urotelialt karsinom
Få praktiske råd for tidlig gjenkjenning og tverrfaglig håndtering av bivirkninger ved kombinasjonsbehandlingen Pembro+EV

KEYTRUDA® + enfortumabvedotin (EV) er indisert som førstelinjebehandling av pasienter med lokalavansert eller metastatisk urotelialt karsinom.1
Studien denne indikasjonen er basert på er KEYNOTE-A39, en global, randomisert, multisenter, fase 3-studie, som inkluderte 886 voksne pasienter med tidligere ubehandlet lokalavansert eller metastatisk urotelialt karsinom. Studien evaluerte effekten og sikkerheten av pembrolizumab i kombinasjon med enfortumabvedotin (EV) versus platinabasert kjemoterapi.1
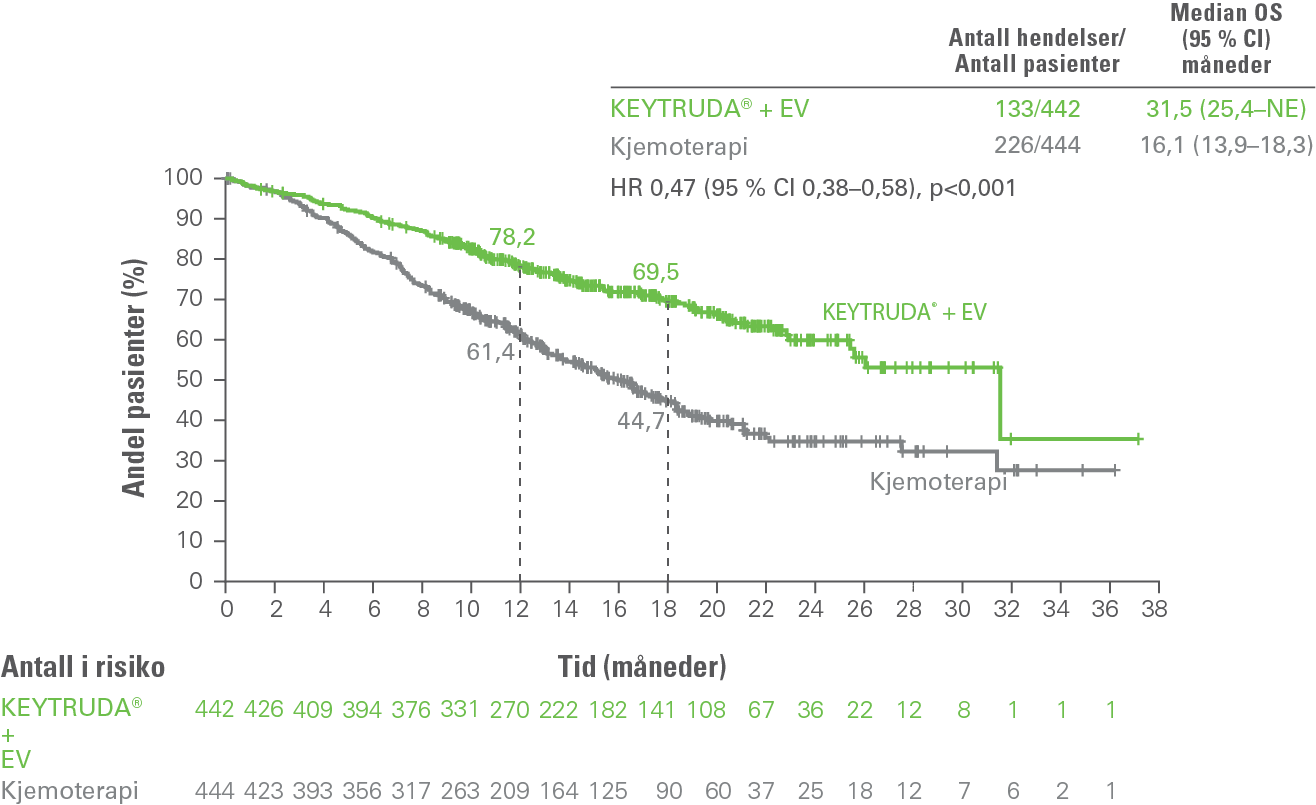
Basert på resultatene fra KEYNOTE-A39, anbefales kombinasjonsterapien pembrolizumab+EV av European Association of Urology (EAU) og ESMOs internasjonale retningslinjer for blærekreft som ny standardbehandling for pasienter med lokalavansert eller metastatisk urotelialt karsinom.2
KEYTRUDA, konsentrat til infusjonsvæske, oppløsning (25 mg/ml, 4 ml hetteglass): 41 553,80 NOK (Apotek utsalgspris). Reseptgruppe: C, Refusjon: H-resept. KEYTRUDA er inkludert i anbud for kreftlegemidler (LIS 2307) og selges med rabattert pris. Denne behandlingen er godkjent til å tas i bruk fra og med 1. juli 2025.1
KEYNOTE-A39 er en global, randomisert, multisenter, fase 3-studie, som inkluderte 886 voksne pasienter med tidligere ubehandlet lokalavansert eller metastatisk urotelialt karsinom. Pasientene ble randomisert 1:1 til behandling med enten KEYTRUDA® (pembrolizumab) i kombinasjon med enfortumabvedotin (EV) (n=442) eller kjemoterapi i form av gemcitabin og cisplatin eller karboplatin (n=444).1 Median oppfølgingstid: 17,2 måneder (intervall: 0,3 til 37,2 måneder).1,3
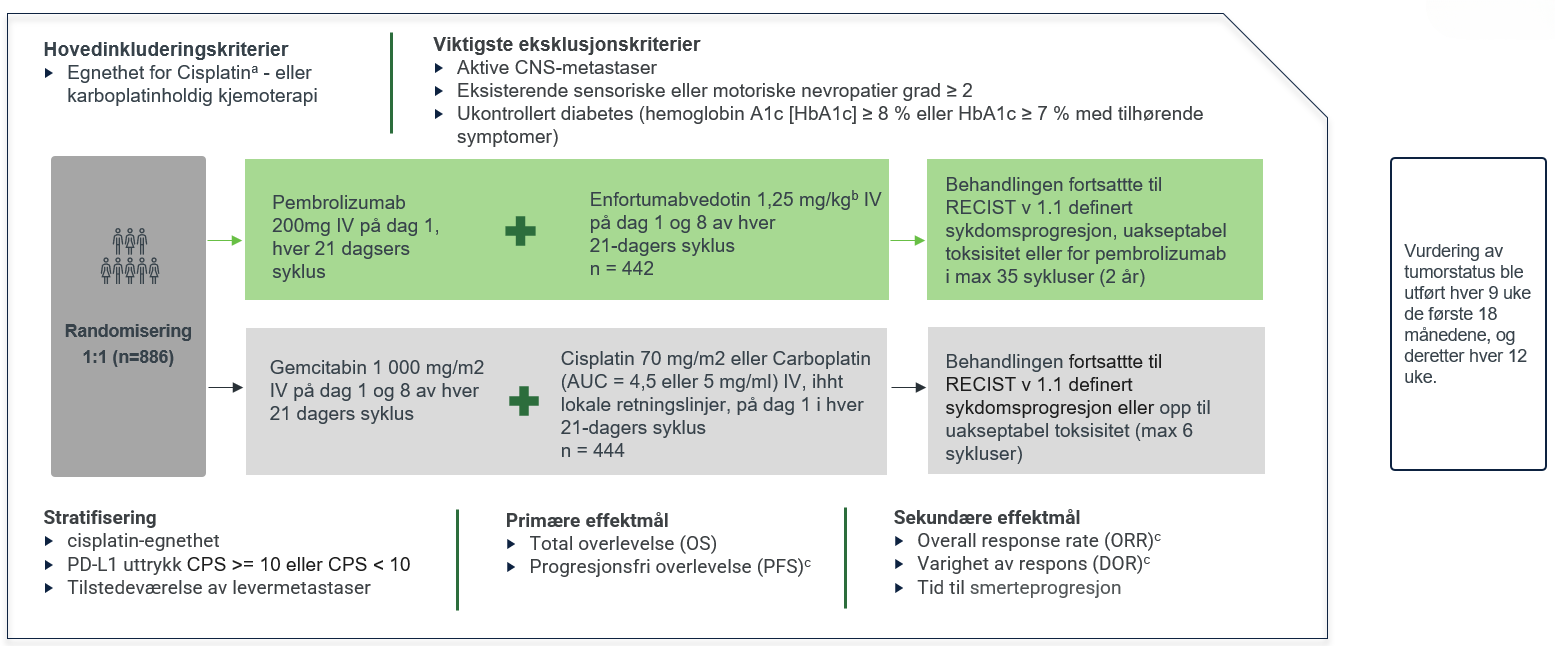
a.Pasienter ble ansett som ikke kvalifisert for cisplatin hvis de hadde minst ett av følgende kriterier: glomerulær filtrasjonshastighet på 30 – 59 ml/min, ECOG PS ≥ 2, hørselstap grad ≥ 2 eller NYHA klasse III hjertesvikt.
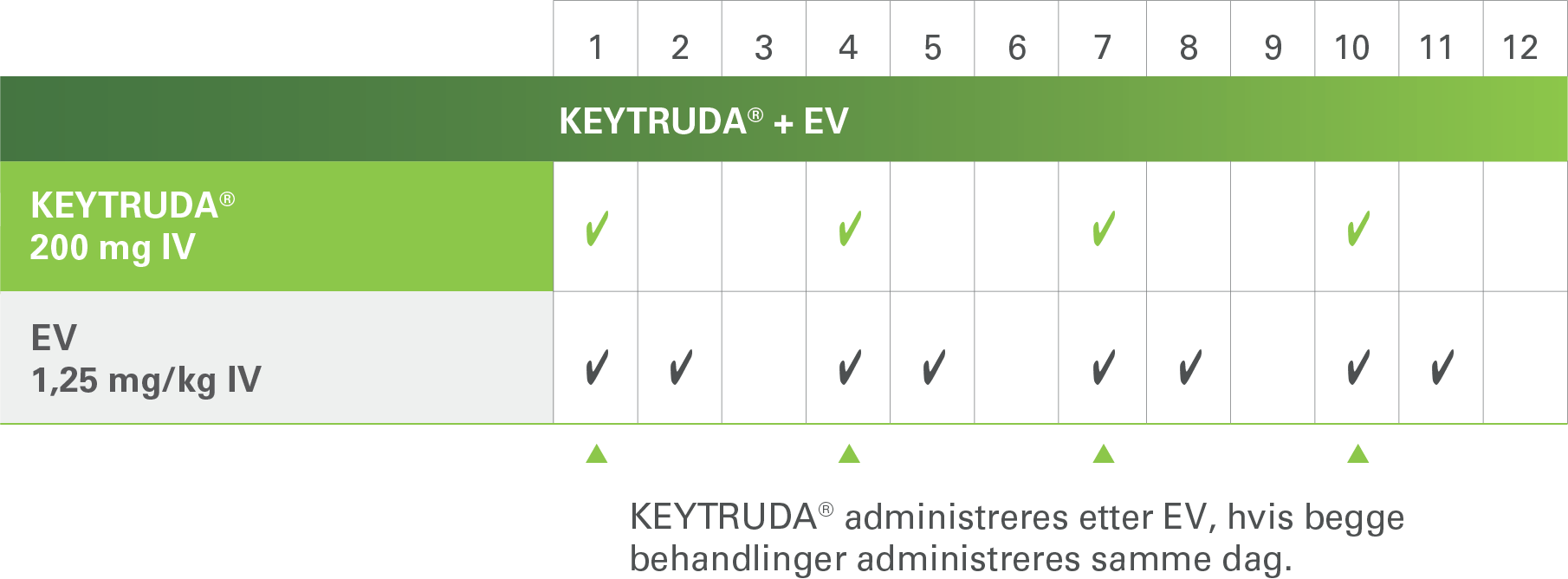
b.IV infusjon over 30 minutter. Ved administrering samme dag, ble KEYTRUDA® administrert etter enfortumabvedotin.
c.Evaluert av BICR i henhold til RECIST v1.1;

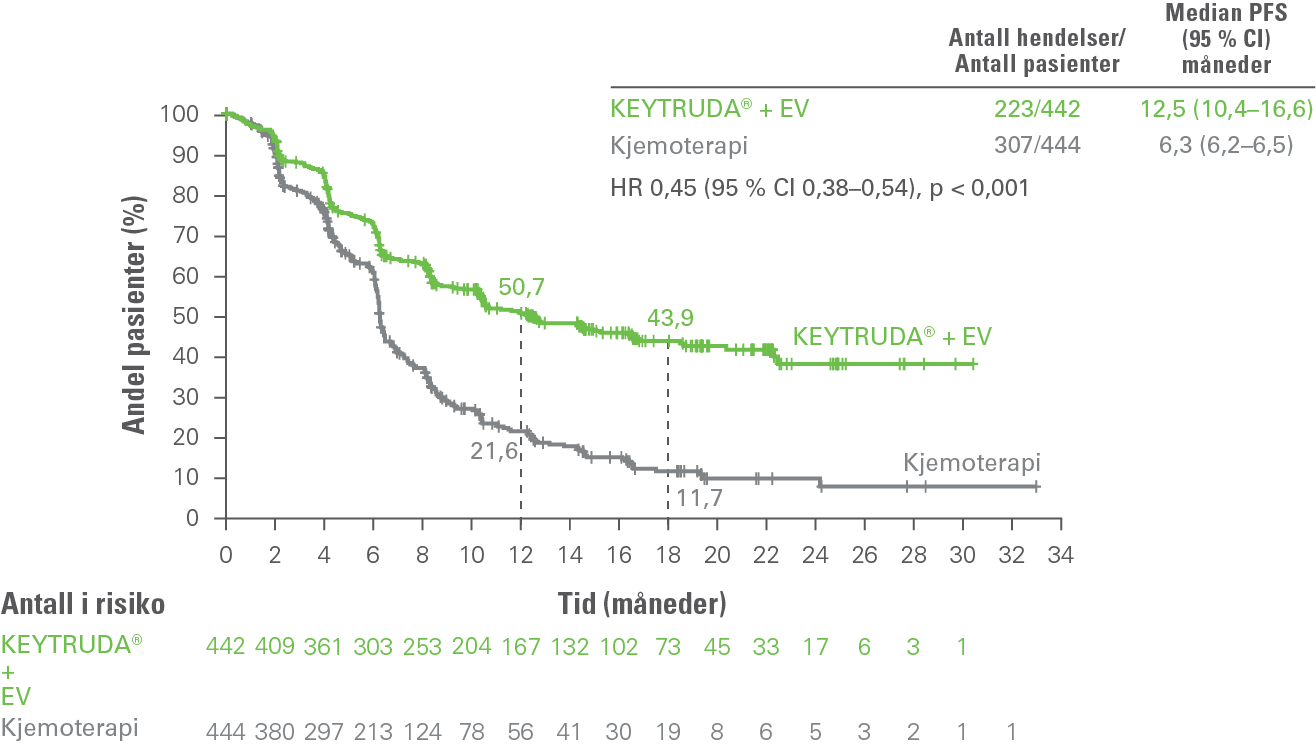
De sekundære effektmålene var komplett responsrate (ORR), varighet av respons (DOR) og smerteprogresjon1.
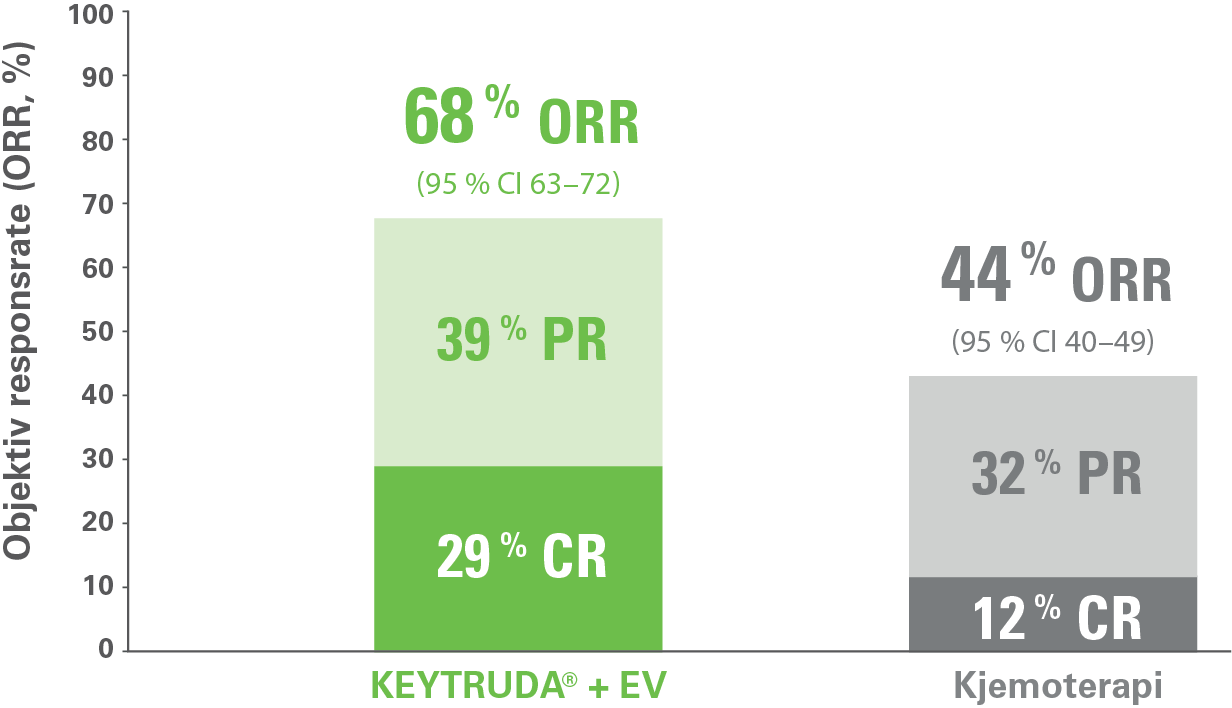
Høyere komplett respons (CR) og partiell respons (PR) med KEYTRUDA® + EV sammenlignet med kjemoterapi
Ett av KEYNOTE-A39-studiens sekundære endepunkter var objektiv responsrate (ORR) definert som komplett eller delvis respons bekreftet ved BICR-vurdering i henhold til RECIST 1.1.3
Komplett respons (CR) ble observert blant 29 % (n=127/437) av pasientene som ble behandlet med kombinasjonen av KEYTRUDA® og EV, sammenlignet med 12 % (n=55/441) av pasientene som ble behandlet med kjemoterapi. Samlet ORR, bekreftet som komplett eller partiell respons, var signifikant høyere blant pasienter i KEYTRUDA® + EV-armen enn blant pasienter i kjemoterapi-armen: 68 % (95 % CI 63–72) vs. 44 % (95 % CI 40–49); p < 0,001.3
Et annet av KEYNOTE-A39 studiens sekundære endepunkter var median responsvarighet (mDOR) bekreftet ved BICR-vurdering i henhold til RECIST 1.1. Den mediane responsvarigheten ble ikke oppnådd i KEYTRUDA® + EV-gruppen, mens den i kjemoterapi-gruppen var 7 måneder.3

Sikkerhetsprofilen for KEYTRUDA® i kombinasjon med EV var i overensstemmelse med tidligere analyser av denne kombinasjonsbehandlingen. Det ble ikke identifisert noen nye bivirkninger i KEYNOTE-A39-studien.3
Behandlingsrelaterte bivirkninger forekom hos 97 % (n=427) av pasientene i KEYTRUDA®+EV-armen vs. 95,6 % (n=414) av pasientene i kjemoterapi-armen.3
Behandlingsrelaterte bivirkninger av grad 3 eller verre oppstod hos 55,9 % av pasientene som ble behandlet med KEYTRUDA® + EV, sammenlignet med 69,5 % av pasientene som ble behandlet med kjemoterapi. De hyppigst forekommende grad ≥ 3 bivirkninger var makulopapulært utslett (7,7 %), hyperglykemi (5,0 %) og nøytropeni (4,8 %) i KEYTRUDA® + EV-armen. I kjemoterapi-armen var det anemi (31,4 %), nøytropeni (30,0 %) og trombocytopeni (19,4 %).3
Hudreaksjoner (grad ≥ 3) var en behandlingsrelatert bivirkning av særlig interesse. Hudreaksjoner som tidligere har vært forbundet med behandling med EV, oppstod hos 15,5 % av pasientene i KEYTRUDA® + EV-armen. Alvorlige hudreaksjoner som tidligere har vært forbundet med behandling med KEYTRUDA®, forekom hos 11,8 % av pasientene i KEYTRUDA® + EV-armen.3 Pasienter som opplever hudreaksjoner, bør raskt oppsøke behandlende avdeling for å begrense ytterligere forverring av tilstanden.
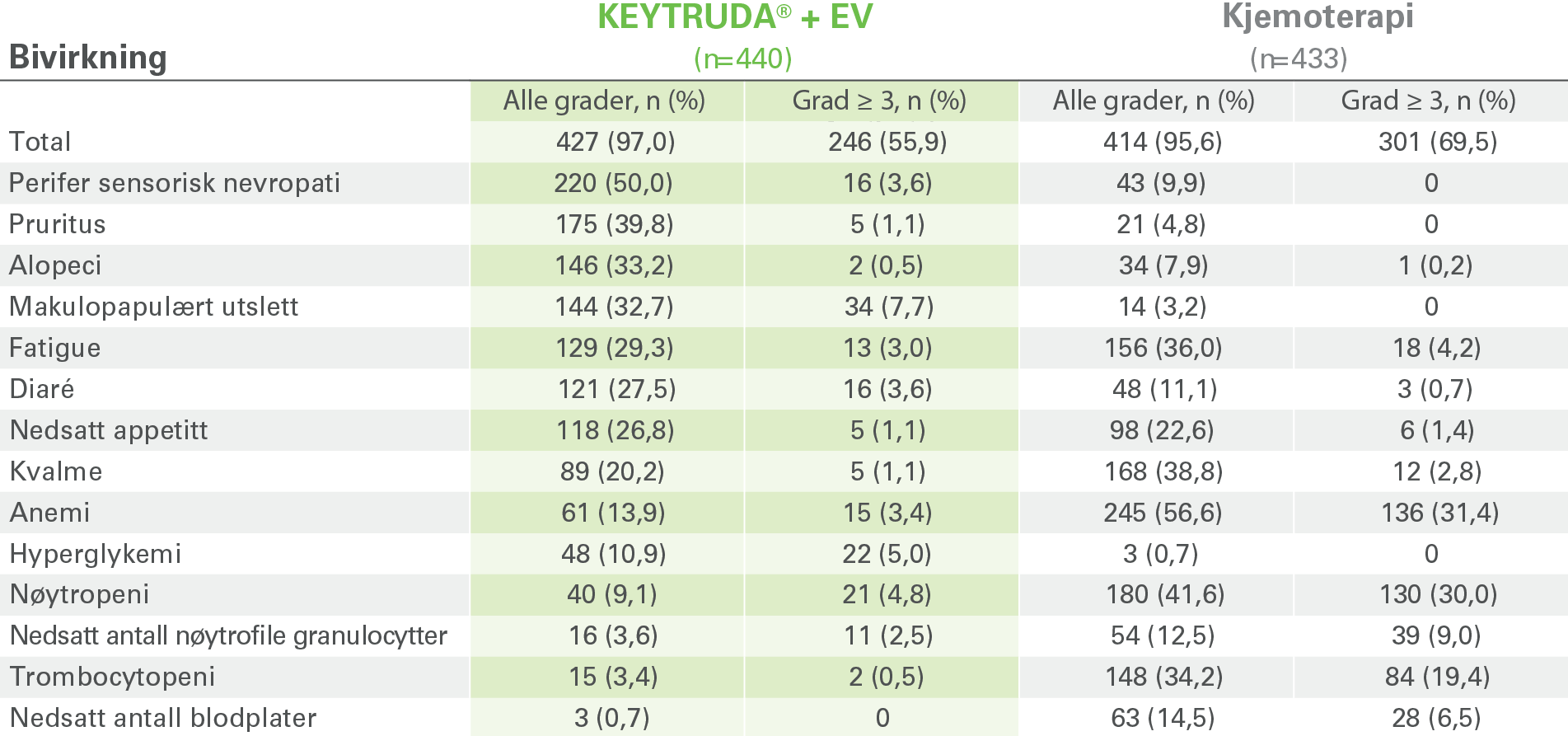
aInkludert er behandlingsrelaterte bivirkninger som forekom hos minst 20 % av pasientene i begge behandlingsgruppene, og behandlingsrelaterte bivirkninger av grad 3 eller høyere som forekom hos minst 5 % av pasientene i begge behandlingsgruppene. Behandlingsrelaterte uønskede hendelser er de som det er en rimelig mulighet for at de er forårsaket av prøvebehandlingen, vurdert av utrederen. Denne analysen inkluderte alle pasientene som hadde fått en hvilken som helst dose av prøvebehandlingen.
bBivirkninger ble gradert i henhold til NCI CTCAE, versjon 4.03.EV = enfortumab vedotin; gem/plat = gemcitabine with cisplatin or carboplatin; NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events;
14.Powles T, Valderrama BP, Gupta S, et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024;390:875 – 88. DOI: 10.1056/NEJMoa2312117
Pembrolizumab (KEYTRUDA®) er vanligst assosiert med immunrelaterte bivirkninger. De fleste immunrelaterte bivirkninger som forekom under behandling med KEYTRUDA® var reversible og ble håndtert ved seponering av KEYTRUDA®, administrering av kortikosteroider og/eller støttende behandling1.
Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
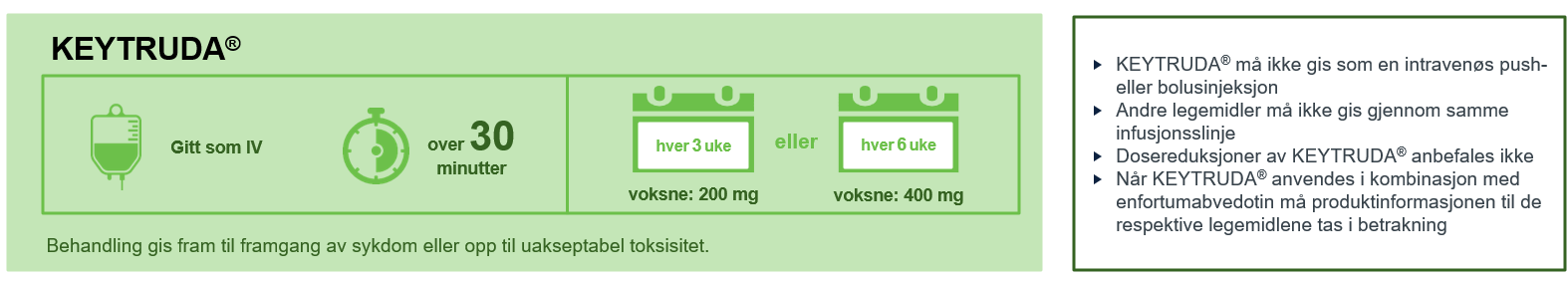
Ved behandling av inoperabel metastatisk blærekreft skal KEYTRUDA gis inntil framgang av sykdom eller uakseptabel toksisitet, eller i en periode opp til 1 år. KEYTRUDA kan gis hver 3. eller 6.uke. Les mer om dosering her: Keytruda – Dosering | MSD Innsikt. Dosereduksjoner av KEYTRUDA® anbefales ikke1.
Enfortumabvedotin skal gis på dag 1 og 8 i en 21 dagers syklus. KEYTRUDA® administreres etter enfortumabvedotin hvis begge deler blir gitt samme dag1.

Vedrana Grcic-van de Pavert – Brand & Customer Manager

Bente Arvesen – Key Account Manager Oncology

For å se innholdet på denne siden må du være autorisert helsepersonell.