PROfound-studien
Lynparza vs komparatorarm (utprøvers valg av NHA)
Sikkerheten og effekten av olaparib ble undersøkt hos menn med metastatisk kastrasjonsresistent prostatakreft (mCRPC) i en fase III randomisert, åpen, multisenterstudie som evaluerte effekten av Lynparza versus en komparatorarm som bestod av utprøvers valg av NHA ([nytt hormonlegemiddel], enten enzalutamid eller abirateronacetat).
Pasientene måtte ha progrediert på tidligere NHA ved behandling av metastatisk prostatakreft og/eller CRPC. For inklusjon i kohort A, måtte pasientene ha skadelige eller mistenkt skadelige mutasjoner i enten BRCA1- eller BRCA2-genene. Pasienter med ATM-mutasjoner ble også randomisert i kohort A, men positivt nytte/risiko-forhold ble ikke påvist hos denne subpopulasjonen. Pasienter med mutasjoner i andre gener ble randomisert i kohort B.
Det primære endepunktet var progresjonsfri overlevelse og det sekundære endepunktet var total overlevelse.
Statistisk signifikant forbedring i BICR-vurdert rPFS for Lynparza vs NHA
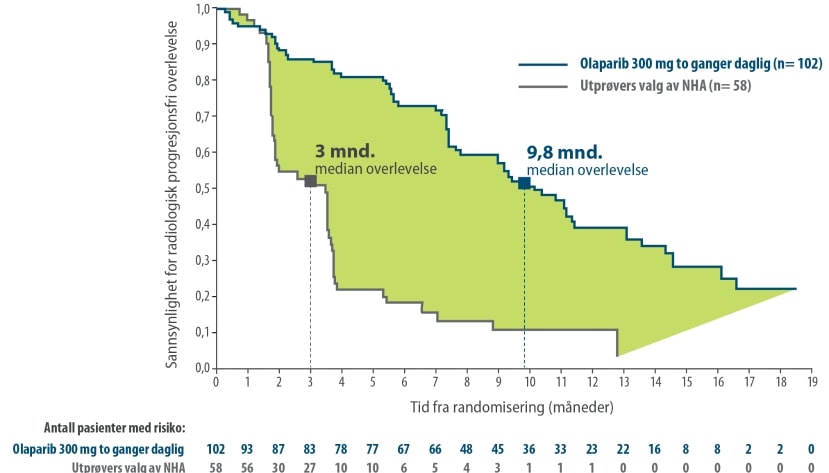
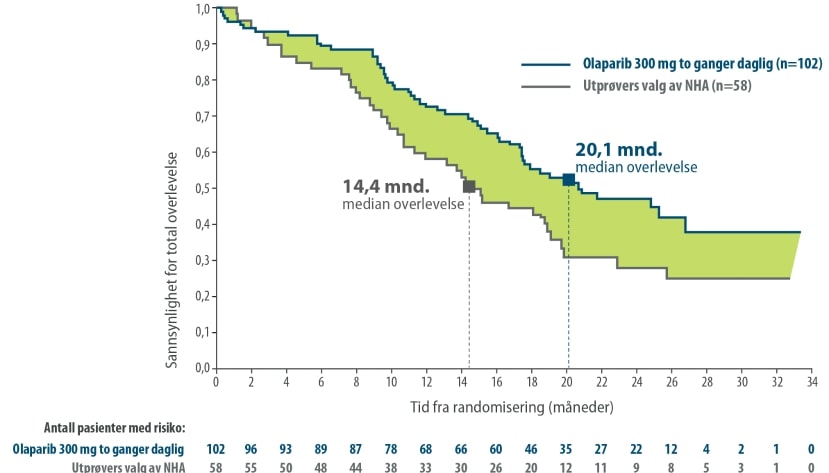
Nominell statistisk signifikant forbedring i OS hos BRCA1/2m-pasienter randomisert til Lynparza sammenlignet med komparator
Sammendrag av viktige effektfunn hos pasienter med BRCA1/2-mutert mCRPC i PROfound
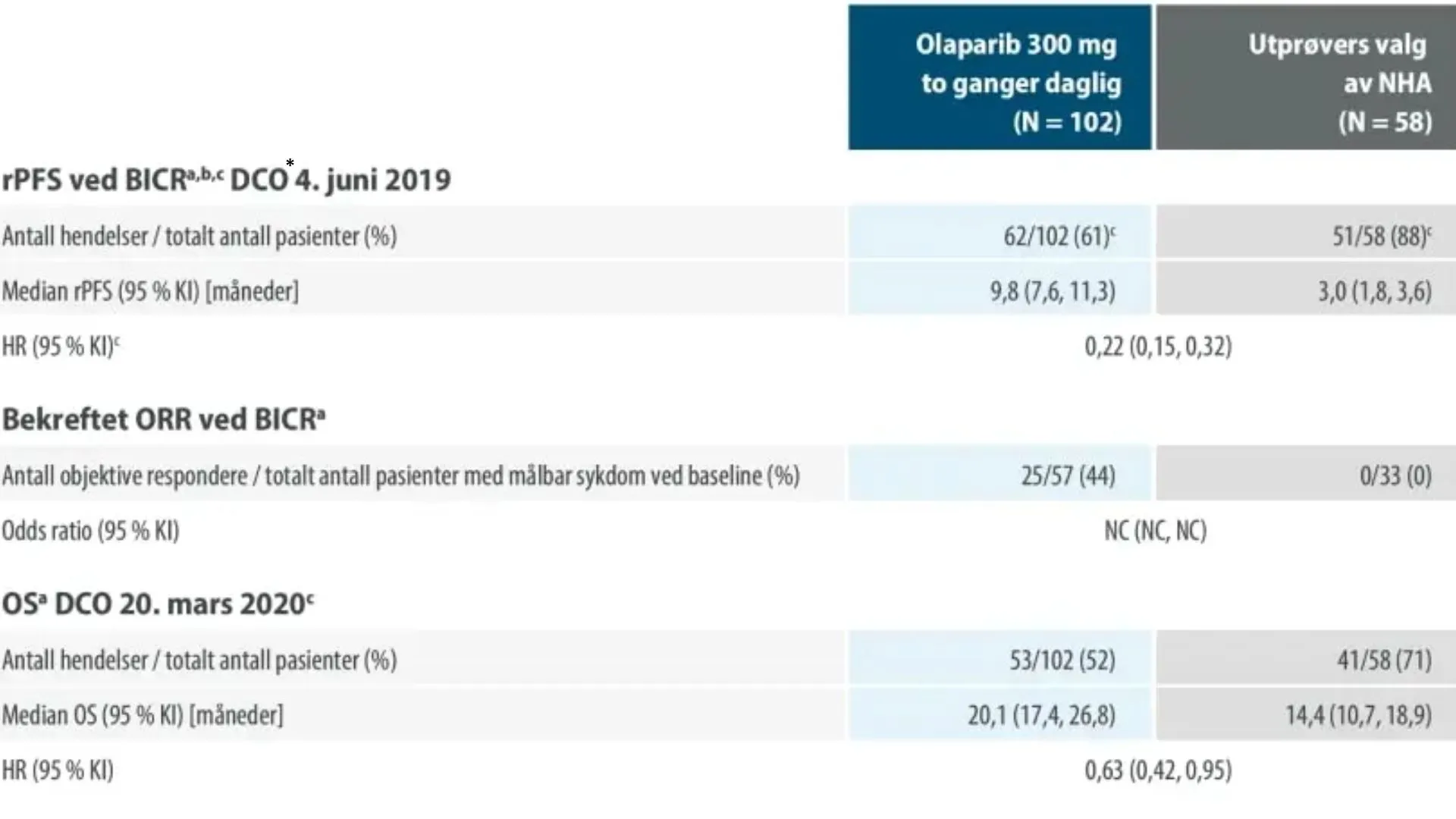
a Ikke kontrollert for mangfold
b rPFS 71 % modenhet
c HR og KI ble beregnet ved bruk av en Cox-proporsjonal hasardmodell som består av vilkår for behandling, faktor og behandling etter faktorinteraksjon. BICR blindet uavhengig sentral vurdering; KI konfidensintervall; HR hasardratio; NC ikke kalkulerbart; NHA nytt hormonlegemiddel; ORR objektiv responsrate; OS total overlevelse; rPFS radiologisk progresjonsfri overlevelse
*Data cut-off
Sikkerhetsdata2
De vanligste bivirkningene var anemi, kvalme og tretthet eller fatigue med olaparib og tretthet eller fatigue med kontrollbehandlingen. Totalt 11 tilfeller av lungeemboli (4% av pasientene) ble rapportert i olaparib-gruppen, sammenlignet med 1 (1%) i kontrollgruppen; ingen var dødelige. Ingen tilfeller av myelodysplastisk syndrom eller akutt myelogen leukemi ble rapportert.
For utfyllende informasjon om sikkerhetsprofilen, se utvalgt sikkerhetsinformasjon og preparatomtalen.
+ Studiedesign
I denne studien ble 387 pasienter randomisert 2:1 til å få enten olaparib (300 mg [2 x 150 mg tabletter] to ganger daglig) eller komparator. I kohort A var det 245 pasienter (162 olaparib og 83 komparator) og i kohort B var det 142 pasienter (94 olaparib og 48 komparator). Pasientene ble stratifisert basert på tidligere taksanbehandling og bevis på målbar sykdom. Behandlingen ble gitt frem til sykdomsprogresjon. Pasienter randomisert til komparator ble gitt valget om å bytte til olaparib ved bekreftet radiologisk BICR-progresjon. Pasienter med BRCA1m, BRCA2m påvist i tumorene ble inkludert på grunnlag av prospektiv sentral testing, med unntak av 3 pasienter som ble inkludert ved bruk av lokalt testresultat. Av de 160 pasientene med en BRCA1- eller BRCA2-mutasjon i PROfound, ble 114 pasienter testet retrospektivt for å bekrefte om den identifiserte BRCA1/2-mutasjonen var av kimbane eller somatisk opphav. Av disse pasientene ble det identifisert 63 BRCA1/2-mutasjoner i kimbane blodprøver, og dermed påvist å være av kimbane opphav. De resterende 51 pasientene hadde ikke en tumorpåvist BRCA1/2-mutasjon identifisert i kimbane blodprøven, og BRCA1/2-mutasjonene ble dermed påvist å være av somatisk opphav. For de gjenværende 46 pasientene er somatisk eller kimbane opphav ukjent.
Demografiske og baseline egenskaper var generelt godt balansert mellom olaparib- og komparatorbehandlingsarmene hos pasienter med BRCA1/2-mutasjoner. Medianalderen var henholdsvis 68 år og 67 år i olaparib- og komparator-behandlingsarmene. Tidligere behandling i olaparib-armen var 71 % taksan, 41 % enzalutamid, 37 % abirateronacetat og 20 % både enzalutamid og abirateronacetat. Tidligere behandling i komparator-armen var 60 % taksan, 50 % enzalutamid, 36 % abirateroneacetat og 14 % både enzalutamid og abirateronacetat. Femtiåtte prosent (58 %) av pasientene i olaparib-armen og 55 % i komparator-armen hadde målbar sykdom ved oppstart av studien. Andelen pasienter med metastaser i skjelett, lymfeknuter, luftveier og lever var henholdsvis 89 %, 62 %, 23 % og 12 % i olaparib-armen og henholdsvis 86 %, 71 %, 16 % og 17 % i komparator-armen. Flertallet av pasientene i begge behandlingsarmene hadde en ECOG på 0 eller 1 (93 %). Baseline smertescore (BPI-SF verste smerte) var 0 – < 2 (52 %), 2 – 3 (10 %) eller > 3 (34 %) i olaparib-armen og 0 – < 2 (45 %), 2 – 3 (7 %) eller > 3 (45 %) i komparator-armen. Median baseline-PSA var 57,48 mikrog/l i olaparib-armen og 103,95 mikrog/l komparator-armen.
Det primære endepunktet til studien var radiologisk progresjonsfri overlevelse (rPFS) i kohort A fastslått ved BICR ved bruk av RECIST 1.1 (bløtvev) og «Prostata Cancer Working Group» (PCWG3) (skjelett). Viktige sekundære endepunkter inkluderte bekreftet objektiv responsrate (ORR) ved BICR, rPFS ved BICR, tid til smerteprogresjon (TTPP) og total overlevelse (OS).
Før forskrivning av Lynparza, se preparatomtalen.
Referanser
- Lynparza SPC, avsnitt 5.1
- de Bono J et al. Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med. 2020;382(22):2091–2102



