I kombinasjon med KISPLYX®
Se filmen under for mer informasjon om KEYNOTE-581 (CLEAR) og resultatene fra interimanalysen.
KEYTRUDA® (Pembrolizumab) – Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
Effektresultatene ved den protokoll-spesifiserte avsluttende analysen med median oppfølgingstid på 49,4 måneder er oppsummert under.
Signifikant forbedret progresjonsfri overlevelse (PFS)1

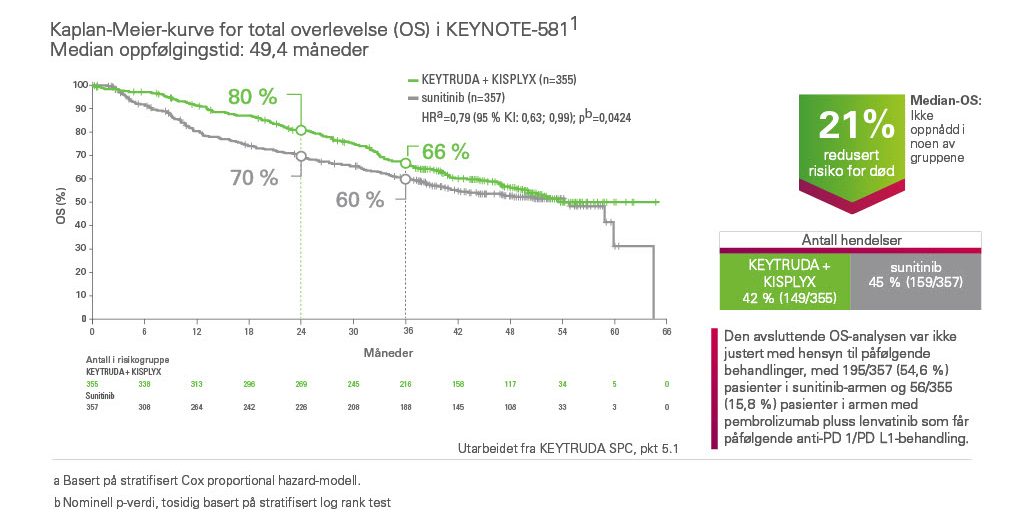
Redusert risiko for død (OS)1
KEYTRUDA i kombinasjon med KISPLYX viste 21 % redusert risiko for død vs. sunitinib ved førstelinjebehandling av RCC.
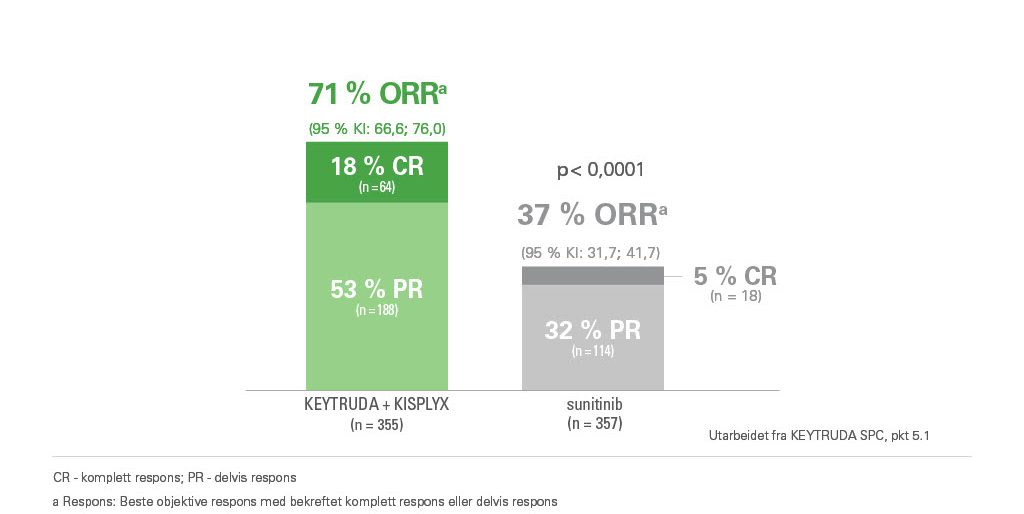
Objektiv responsrate (ORR)1
KEYTRUDA i kombinasjon med KISPLYX viste ORR hos 71% vs. 37% i gruppen som fikk sunitib ved førstelinjebehandling av nyrecellekarsinom (RCC).
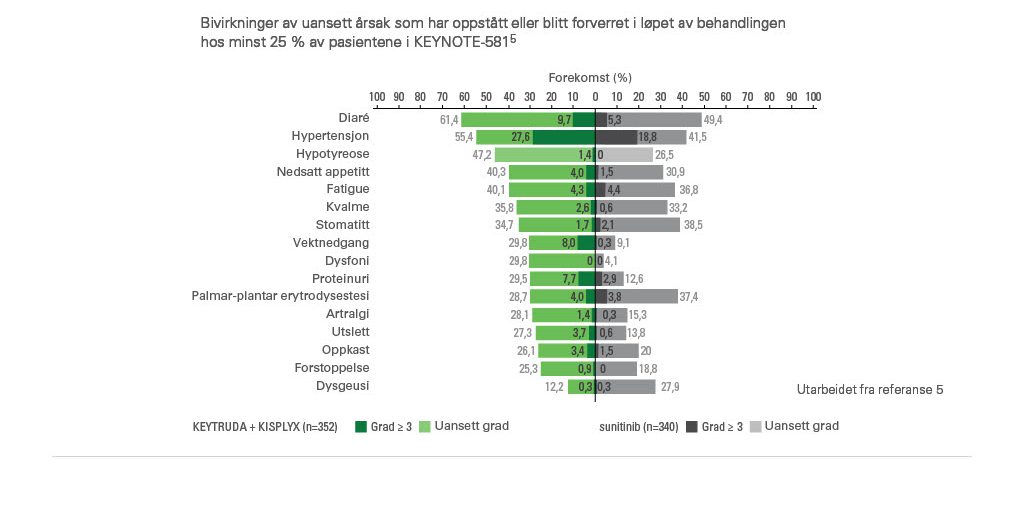
Bivirkninger i KEYNOTE-581-studien5
Sikkerhetsprofil vs. sunitib ved primæranalysen (median oppfølgingstid for overlevelse på 26,5 måneder).
Oppsummering av sikkerhetsprofilen1,2
Kombinasjonen av KEYTRUDA® + KISPLYX® viste en håndterbar sikkerhetsprofil som er i samsvar med de etablerte profilene til de individuelle monoterapiene.
Oppsummering av sikkerhetsprofilen til KEYTRUDA®1
Pembrolizumab (KEYTRUDA®) er vanligst assosiert med immunmedierte bivirkninger. De fleste immunmedierte bivirkninger som forekom under behandling med KEYTRUDA®, var reversible og ble håndtert ved seponering av KEYTRUDA®, administrering av kortikosteroider og/eller støttende behandling.
Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
Oppsummering av sikkerhetsprofilen til KISPLYX®2
Se utfyllende informasjon i preparatomtalen til KISPLYX.
Studiedesign KEYNOTE-581 (CLEAR)1,5
KEYNOTE-581 er en multisenter, åpen, randomisert studie utført hos 1069 pasienter med avansert RCC med klarcellet komponent, inkludert andre histologiske kjennetegn som sarkomatoid og papillær i førstelinje.
Pasienter var inkludert uavhengig av status av PD-L1-uttrykk i tumor. Studien ekskluderte pasienter med autoimmun sykdom eller en medisinsk tilstand som krevde immunsuppresjon.
Pasientene ble randomisert (1:1:1) til en av følgende behandlingsarmer:
- Pembrolizumab 200 mg intravenøst hver 3. uke i opptil 24 måneder i kombinasjon med lenvatinib 20 mg oralt én gang daglig.
- Lenvatinib 18 mg oralt én gang daglig i kombinasjon med everolimus 5 mg oralt én gang daglig.
- Sunitinib 50 mg oralt én gang daglig i 4 uker, etterfulgt av en 2 ukers hvileperiode.
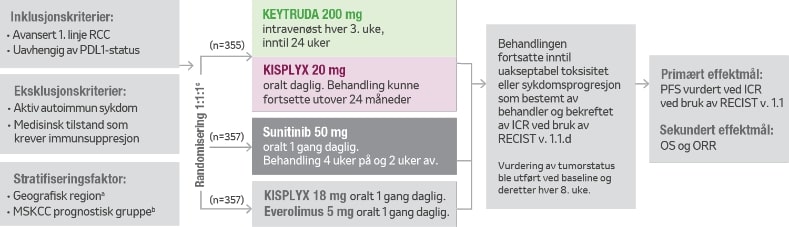
a) Nord-Amerika og Vest-Europa vs «Resten av verden».
b) Randomisering ble stratifisert i henhold til Memorial Sloan Kettering Cancer Center (MSKCC) prognostiske grupper: god vs. intermediær vs. dårlig.
c) Kliniske data er presentert fra KEYTRUDA + KISPLYX og sunitinib-armene.
d) Administrering av KEYTRUDA + KISPLYX var tillatt utover RECIST-definert sykdomsprogresjon dersom pasienten var klinisk stabil og vurdert av utprøveren å ha klinisk fordel av behandling
Dosering1,2
- Når KEYTRUDA administreres i kombinasjon med KISPLYX, henvises det til SPC for KISPLYX før behandlingsstart. Kisplyx (Eisai) Felleskatalogen
- Ved bruk av KEYTRUDA i kombinasjon med KISPLYX bør ett eller begge legemidler tas bort ved behov. KISPLYX bør tilbakeholdes, dosen reduseres eller seponeres i samsvar med instruksjonene i SPC for KISPLYX i kombinasjon med KEYTRUDA. Ingen dosereduksjon er anbefalt for KEYTRUDA.
- KEYTRUDA kan gis hver 3. eller 6. uke. Les mer om dosering her: Keytruda – Dosering | MSD Innsikt
Har du spørsmål rundt KEYTRUDA®? Ta kontakt med oss.

Vedrana Grcic-van de Pavert – Brand & Customer Manager

Bente Arvesen – Key Account Manager Oncology
Referanser
- Keytruda SPC, oktober 2024, 4.1, 4.2, 4.4, 4.8, 5.1
- Kisplyx SPC, mars 2024, 4.1, 4.2, 4.4, 4.8, 5.1
- https://nyemetoder.no/metoder/lenvatinib-kisplyx-pembrolizumab-keytruda
- Onkologi – Sykehusinnkjøp (sykehusinnkjop.no)
- Motzer R, Alekseev B, Rha S-Y, et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med. 2021;384(14):1289–1300