Adjuvant behandling i monoterapi
Primære og sekundære effektmål1,8
Effekt og sikkerhet av KEYTRUDA® som monoterapi til adjuvant behandling ble undersøkt i KEYNOTE-564-
studien. Det primære effektmålet var sykdomsfri overlevelse (DFS) vurdert av utprøver. Det viktigste sekundære
effektmålet var OS.
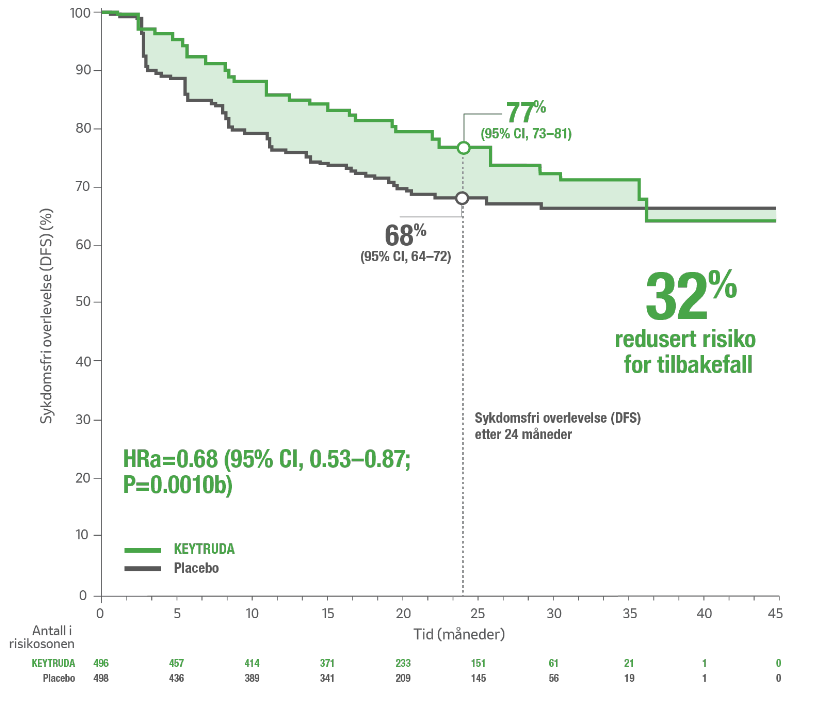
Signifikant reduksjon i risikoen for tilbakefall av sykdom eller død (DFS)8
Effekt og sikkerhet av KEYTRUDA® som monoterapi til adjuvant behandling ble undersøkt i KEYNOTE-564-studien.
Etter en median oppfølging på 24,1 måneder, viste KEYTRUDA® en statistisk signifikant og klinisk meningsfull reduksjon i risikoen for tilbakefall av sykdom eller død med 32 % sammenlignet med placebo8.
2-års estimert sykdomsfri overlevelse (DFS) var 77,3 % for KEYTRUDA® vs. 68,1 % for placebo ved adjuvant behandling av RCC.
Redusert risiko for død (OS)8
KEYTRUDA® oppnådde 46 % reduksjon i risiko for død med sammenlignet med placebo ved adjuvant behandling av nyrecellekarsinom (RCC). Median survival var ikke oppnådd for noen av gruppene da OS-analysen ble gjort. Analysen ble gjort med utgangspunkt i at det var 51 dødsfall totalt, 33 i placeboarmen mot 18 i pembrolizumabarmen, ved analysetidspunktet.
Bivirkninger i KEYNOTE-564-studien8
Bivirkinger med ≥10% forekomst.
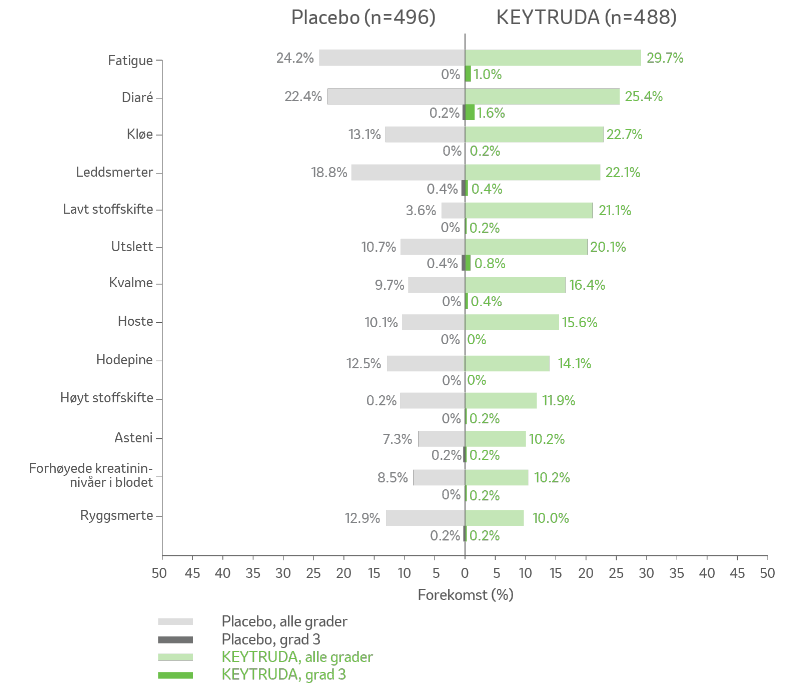
Alle bivirkninger8
Enhver bivirkning og behandlingsrelatert bivirkning (populasjon behandlet)*
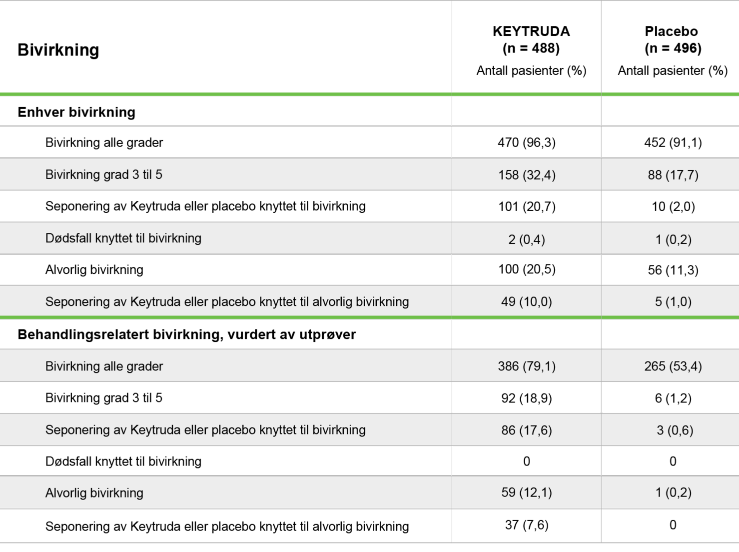
*Populasjonen som ble behandlet inkluderte alle pasienter som fikk minst én dose Keytruda eller placebo. Bivirkninger ble registrert fra randomisering til 30 dager etter seponering av Keytruda eller placebo. Alvorlige uønskede hendelser ble definert som enhver uønsket hendelse som resulterte i død, var livstruende, resulterte i sykehusinnleggelse eller forlengelse av eksisterende sykehusinnleggelse, resulterte i vedvarende eller betydelig funksjonshemming eller inhabilitet, var en medfødt anomali eller fødselsdefekt, eller ble vurdert av behandler å være en alvorlig uønsket hendelse. Alvorlige bivirkninger ble registrert fra randomisering til 90 dager etter seponering av Keytruda eller placebo.
Oppsummering av sikkerhetsprofilen til KEYTRUDA®1
Pembrolizumab (KEYTRUDA®) er vanligst assosiert med immunrelaterte bivirkninger. De fleste immunrelaterte bivirkninger som forekom under behandling med KEYTRUDA® var reversible og ble håndtert ved seponering av KEYTRUDA®, administrering av kortikosteroider og/eller støttende behandling1.
Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
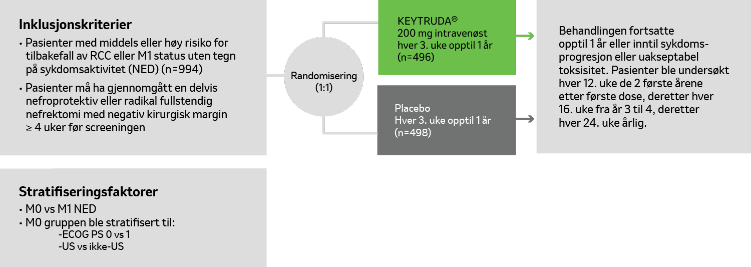
Studiedesign KEYNOTE-564-studien8
KEYNOTE-564 er en av de første fase III-studiene som undersøker en PD1-hemmer som adjuvant behandling etter nefrektomi ved klarcellet nyrekreft.
Studien inkluderer 994 pasienter med middels eller høy risiko for tilbakefall, som innenfor 12 uker etter operasjon ble randomisert 1:1 til 17 behandlinger med pembrolizumab hver tredje uke eller placebo.
Dosering1
Ved adjuvant behandling av melanom eller RCC skal KEYTRUDA® gis inntil tilbakefall, uakseptabel toksisitet eller i en periode på opptil 1 år.
Les mer om dosering av KEYTRUDA® her: Keytruda – Dosering | MSD Innsikt
Hva er verdien av tidlige endepunkt i kliniske kreftstudier?
En klinisk studie i senere fase har som mål å evaluere den kliniske effekten og sikkerheten av en ny […]
Har du spørsmål rundt KEYTRUDA®?
Ta kontakt med meg.

Tom Einar Løkkemyhr – Brand Manager Oncology
Referanser
- Keytruda SPC, august 2023, 4.1, 4.2, 4.8, 5.1
- Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nyrecellekreft. Helsedirektoratet. 2023
- Dabestani S, Beisland C, Stewart GD, et al. Long-term Outcomes of Follow-up for Initially Localised Clear Cell Renal Cell Carcinoma: RECUR Database Analysis. Eur Urol Focus. 2019;5(5):857-66
- Haas NB, Song Y, Willemann Rogerio J, et al. Disease-free survival as a predictor of overall survival in localized renal cell carcinoma following initial nephrectomy: A retrospective analysis of Surveillance, Epidemiology and End Results-Medicare datac. Int J Urol. 2023;30(3):272-9
- Martinez Chanza N, Tripathi A, Harshman LC. Adjuvant Therapy Options in Renal Cell Carcinoma: Where Do We Stand? Curr Treat Options Oncol. 2019;20(5):44.
- Powles T, Albiges L, Bex A, et al. ESMO Clinical Practice Guideline update on the use of immunotherapy in early stage and advanced renal cell carcinoma. Ann Oncol. 2021;32(12):1511-9
- Bedke J, Albiges L, Capitanio U, et al. 2021 Updated European Association of Urology Guidelines on the Use of Adjuvant Pembrolizumab for Renal Cell Carcinoma. European urology. 2022;81(2):134-7
- RChoueiri T.K., Tomczak P., Park S.H., et al. Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med. 2021;38(8):683–694.