Pasientseleksjon
Neoadjuvant behandling av trippel negativ brystkreft (TNBC). Hvilke pasienter har nytte av behandlingen?

KEYNOTE-522 (KN-522) er en fase III, randomisert, multisenter, dobbeltblind, placebokontrollert studie utført på 1174 pasienter med nylig diagnostisert, tidligere ubehandlet høyrisiko tidlig stadium eller lokalavansert TNBC.
TNBC er en aggressiv form for brystkreft, og risikoen for tilbakefall av sykdommen og død er høyere i stadium II og III for denne pasientgruppen enn for andre brystkrefttyper. Risikoen øker med spredning til lymfeknuter og størrelsen på svulstene. I Norge ble ca. 8% av alle pasienter med brystkreft diagnostisert med trippel negativ brystkreft i 20231.
KN-522 studien har vist at neoadjuvant behandling med KEYTRUDA® (pembrolizumab) + kjemoterapi etterfulgt av adjuvant KEYTRUDA® ledet til statistisk signifikant hendelsesfri overlevelse, inkludert lenger tid til tilbakefall (EFS) og en bedre patologisk komplett respons sammenlignet med dagens standardbehandling med kjemoterapi2. Etter 73,1 måneder viste studien også en statistisk signifikant forbedring i total overlevelse (OS) hos pasienter behandlet med KEYTRUDA®+kjemoterapi/KEYTRUDA® sammenlignet med kjemoterapi+placebo/placebo2,4. På denne siden kan du lese mer utdypende om resultatene fra KN-522.
INDIKASJON, PRIS, REFUSJON OG UTLEVERINGSBETINGELSER:
Utvalgt indikasjon: Trippel negativ brystkreft: KEYTRUDA i kombinasjon med kjemoterapi som neoadjuvant behandling, etterfulgt som monoterapi som adjuvant behandling etter kirurgi, er indisert til behandling hos voksne med lokalavansert eller tidlig stadium trippel-negativ brystkreft med høy risiko for tilbakefall.
Pris: 41 553,80 NOK (Apotek utsalgspris). Reseptgruppe: C, Refusjon: H-resept. Keytruda er inkludert i anbud for kreftlegemidler (LIS 2307) og selges med rabattert pris.
Keytruda er godkjent i Beslutningsforum for indikasjonene innen trippel negativ brystkreft.
1. juli 2025
Se video med Professor Peter Schmid som forklarer de siste, oppdaterte resultatene fra KEYNOTE-522 studien (varighet 4:30 min) eller les videre på siden for studiedetaljer og de siste oppdaterte resultatene etter 73 måneders oppfølging.


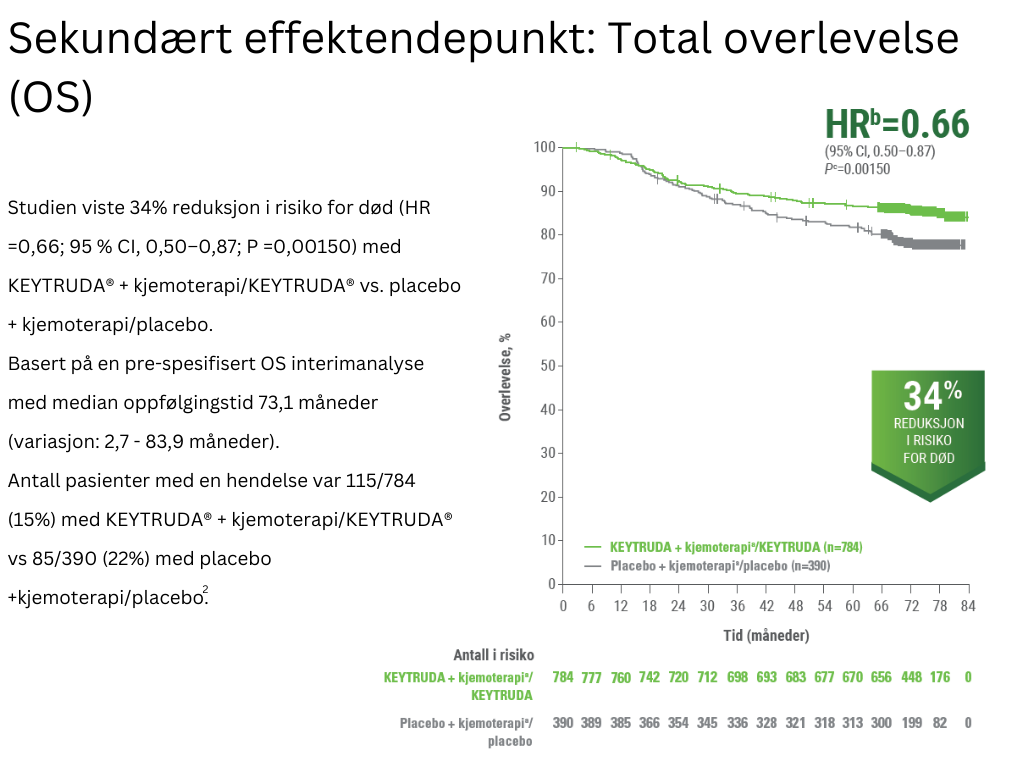
bBasert på Cox‑regresjonsmodell med Efrons metode («tie handling») med behandling som en kovariant stratifisert ved lymfeknutestatus, tumorstørrelse og valg av karboplatin cEnsidig p‑verdi basert på log‑rank test stratifisert ved lymfeknutestatus, tumorstørrelse og valg av karboplatin
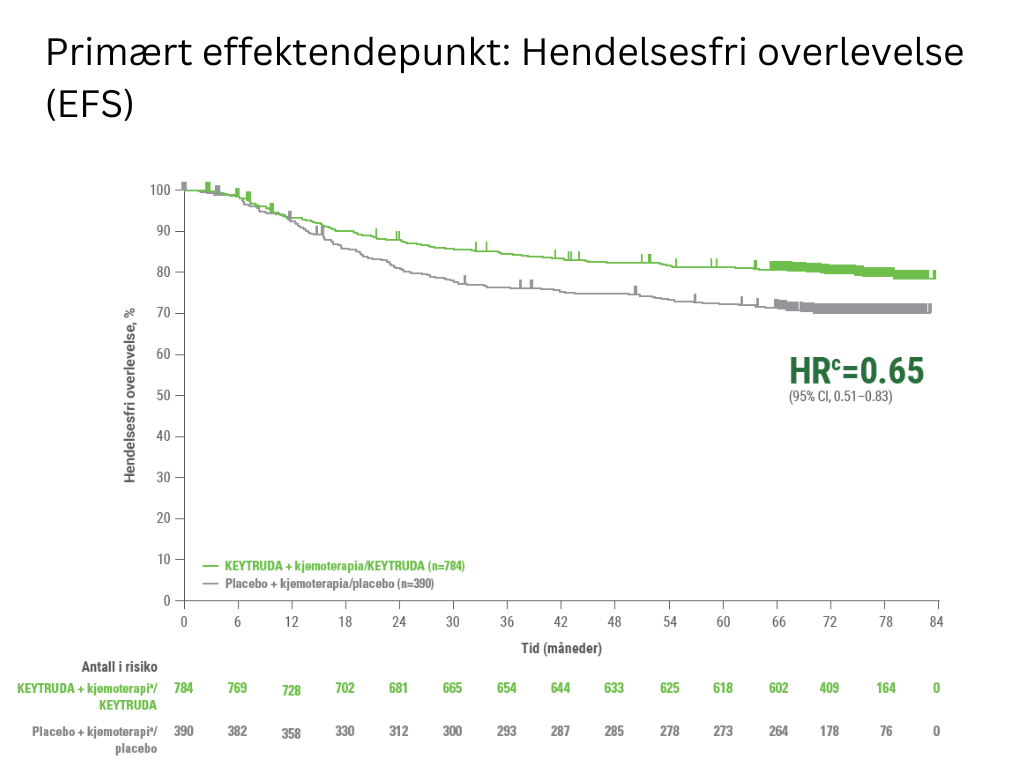
c Basert på Cox‑regresjonsmodell med Efrons metode («tie handling») med behandling som en kovariant stratifisert ved lymfeknutestatus, tumorstørrelse og valg av karboplatin
Median oppfølgingstid var 73,1 måneder (variasjon: 2,7 – 83,9 måneder). Ingen formell statistisk testing ble gjort for denne pre-spesifiserte interimanalysen av EFS, derfor kan ingen konklusjoner dras.
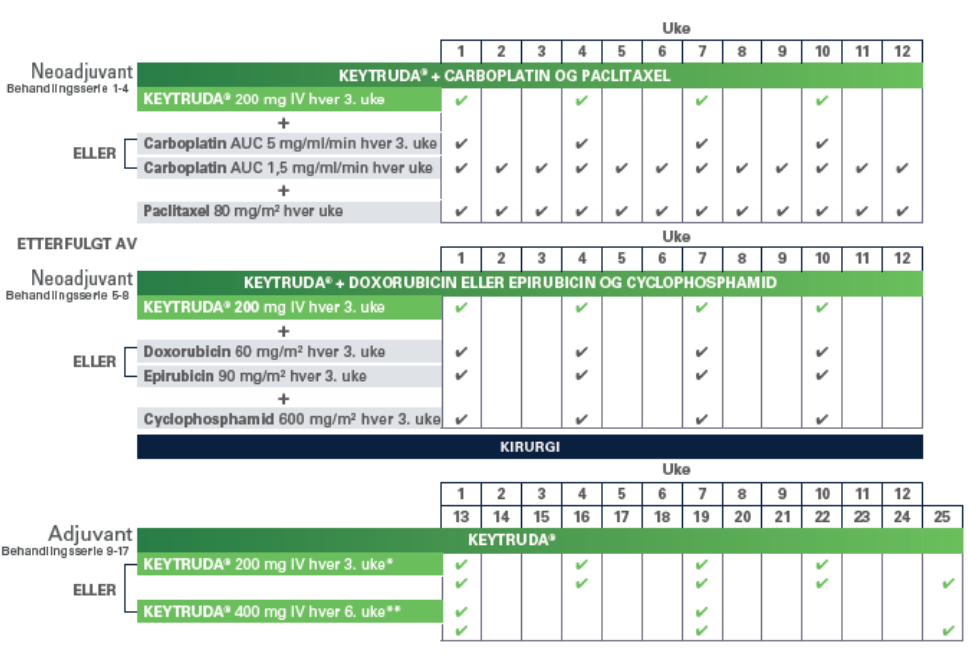
Den anvendte dosering i KEYNOTE-522 for både neoadjuverende og adjuverende behandlingsserier kan du se nedenfor.
Sikkerhetsprofilen til KEYTRUDA® i kombinasjon med kjemoterapi, gitt som neoadjuvant behandling og fortsatte som monoterapi adjuvant behandling, var i samsvar med kjente bivirkninger for hver individuelle behandling og med de som ble observert i andre kombinasjonsstudier med KEYTRUDA®.
Bivirkningene var:
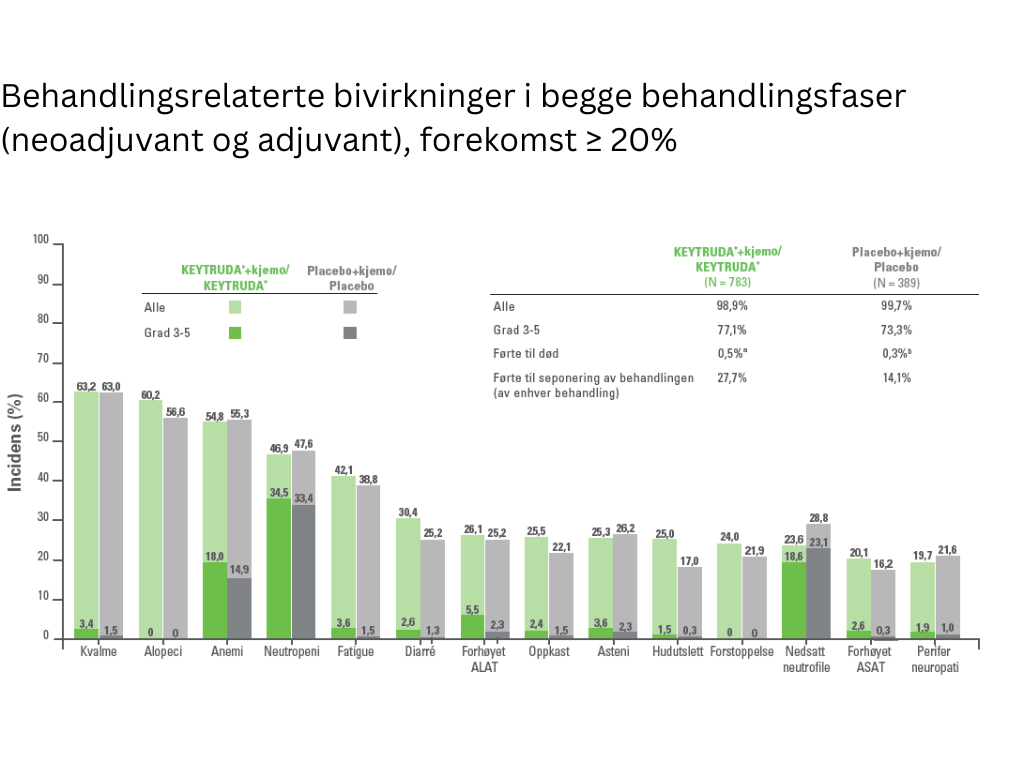
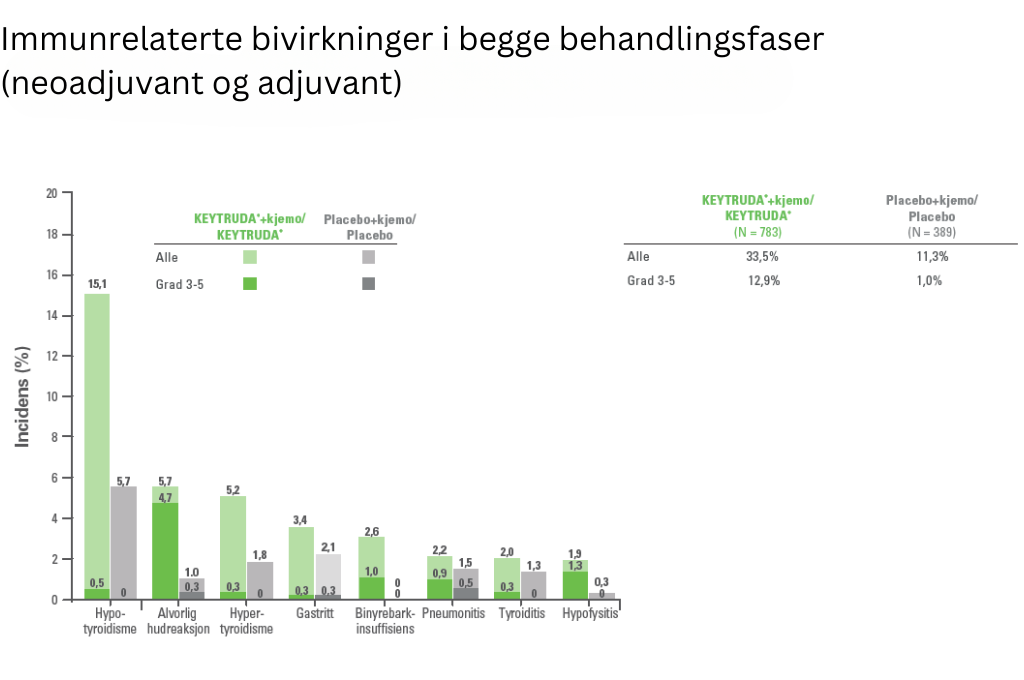
Pembrolizumab (KEYTRUDA®) er vanligst assosiert med immunrelaterte bivirkninger. De fleste immunrelaterte bivirkninger som forekom under behandling med KEYTRUDA® var reversible og ble håndtert ved seponering av KEYTRUDA®, administrering av kortikosteroider og/eller støttende behandling. Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
Studien viste en statistisk signifikant forbedring i forskjell i pCR rate ved dens pre-spesifiserte primæranalyse, samt en statistisk signifikant forbedring i EFS. Ved en median oppfølgingstid for alle pasienter på 73,1 måneder (variasjon: 2,7-83,9 måneder) viste studien også en statistisk signifikant forbedring i OS2
Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
KEYTRUDA® kan gis hver 3. eller 6. uke. Les mer om dosering her: Keytruda – Dosering | MSD Innsikt.
Har du spørsmål rundt KEYTRUDA®? Ta kontakt med oss.

For å se innholdet på denne siden må du være autorisert helsepersonell.